原电池是化学对人类的一项重大贡献。某兴趣小组为研究原电池原理,设计如图装置:
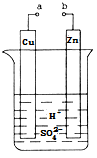
(1)a和b用导线连接,Cu极为原电池_________极(填“正”或“负”),电极反应式为 Zn极发生_________(填“氧化”或“还原”)反应。溶液中H+移向____________(填“Cu”或“Zn”)极。
(2)无论a和b是否连接,Zn片均被腐蚀。若转移了0.2mol电子,则理论上Zn片质量减轻______g。
(3)有同学想把Ba(OH)2•8H2O晶体与NH4Cl晶体的反应设计成原电池,你认为是否可行? (填“是”或“否”),理由是 。
在常温下,下列三种溶液:①0.1mol/L NH4Cl②0.1mol/L CH3COONH4③0.1mol/L NH4HSO4
请根据要求填写下列空白:
(1)溶液①呈性(填“酸”、“碱”或“中”),其原因是:
(用离子方程式表示)
(2)在上述三种溶液中,pH最小的是;c(NH4+)最小的是﹝填序号﹞
(3)常温下,测得溶液②的pH=7,则说明CH3COO-的水解程度________(填“>”、“<”或“=”)NH4+的水解程度,CH3COO-与NH4+浓度的大小关系是:
c(CH3COO-) c(NH4+)(填“>”、“<”或“=”)
A、B、C、D、E 5瓶透明溶液,分别是HCl、BaCl2、NaHSO4、Na2CO3和AgNO3中的一种。已知:
①A与B反应有气体生成 ②B与C反应有沉淀生成
③C与D反应有沉淀生成 ④D与E反应有沉淀生成
⑤A与E反应有气体生成⑥在②和③的反应中生成的沉淀是同一种物质
请填空:
(1)在反应③中,生成的沉淀物质的化学式是。
(2)C是, E是(填化学式)。
(3)A与E反应的离子方程式是。
将24.4 g Na OH固体溶于水配成100m L溶液,其密度为1.219 g / mL
(1)该溶液中NaOH的物质的量浓度为。
(2)该溶液中NaOH的质量分数为。
(3)从溶液中取出10ml,其中NaOH的物质的量浓度为,NaOH的质量分数为,溶液的密度为,含NaOH的质量为,含NaOH的物质的量为。
(4)将取出的10mL溶液加水稀释到100 mL,稀释后溶液NaOH的物质的量浓度为
。
(1)谋晶体的化学式为Na0.35CoO2 • 1.3H2O。试计算:该晶体的摩尔质量是;
钴原子与氧原子的物质的量之比是; 1mol该晶体中含有的氧原子数目
是。
(2)每组中都有一种物质与其他物质在分类上或性质上不同,试分析每组中物质的组成规律或性质特点,将这种物质找出来,并说明理由。
①O2CO H2 Mg, ;
②CO2SO3 CO CaO, 。
(3)10g碳酸钙溶于100ml盐酸溶液,恰好完全反应。写出该反应的离子方程式,标准状况下生成气体体积L,盐酸的物质的量的浓度mol/L.
现用18.4 mol·L-1的浓H2SO4来配制250 mL、0.300 mol·L-1的稀H2SO4。可供选择的仪器有: ①药匙 ②量筒③托盘天平④玻璃棒⑤烧瓶
⑥胶头滴管⑦容量瓶⑧烧杯。 请回答下列问题:
(1)上述仪器中,在配制稀H2SO4时用不到的有(填代号)。
(2)经计算,需浓H2SO4的体积为。
现有①5 mL②10 mL③20 mL三种规格量筒,你选用的量筒是(填代号)。