下列电离方程式不正确的是
| A.H2SO4=2H++SO42- | B.NH4NO3=NH4++NO3- |
| C.Na2CO3=Na2++CO32- | D.Ba(OH)2=Ba2++2OH- |
U常见化合价有+4和+6,硝酸铀酰[UO2(NO3)2]加热可发生如下分解反应:
UO2(NO3)2 —— UxOY + NO2↑+ O2↑(未配平),在600K时,将气体产物收集于试管中并倒扣于水中气体全部被吸收,水充满试管。则生成的铀的氧化物化学式是
| A.UO3 | B.UO2 | C.2UO2·UO3 | D.UO2·2UO3 |
物质制备过程中离不开物质的提纯。以下除杂方法不正确的是
| 选项 |
目的 |
实验方法 |
| A |
除去Na2CO3固体中的NaHCO3 |
置于坩埚中加热至恒重 |
| B |
除去NaCl中少量KNO3 |
将混合物制成热饱和溶液,冷却结晶,过滤 |
| C |
除去CO2中的HCl气体 |
通过NaHCO3(aq,饱和),然后干燥 |
| D |
除去C2H5Br中的Br2 |
加入足量Na2SO3(aq),充分振荡,分液 |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.3mol NF3与水完全反应生成HF、HNO3和NO,转移电子数2NA |
| B.22.4L CO2与过量的Na2O2反应,转移的电子数为NA |
| C.60 g SiO2晶体中含有2 NA个Si-O键 |
| D.常温下,5.6g铁钉与足量浓硝酸反应,转移的电子数为0.3NA |
实验装置是为达成实验目的选用的。下列实验装置与实验目的相匹配的是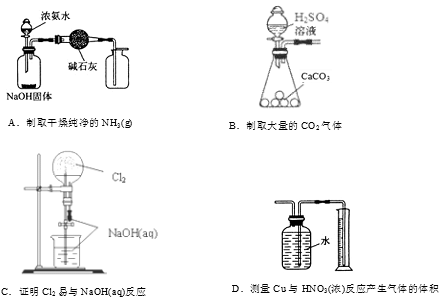
下列有关物质性质、结构的表述均正确,且存在因果关系的是
| 表述Ⅰ |
表述Ⅱ |
|
| A |
在形成化合物时,同一主族元素的化合价相同 |
同一主族元素原子的最外层电子数相同 |
| B |
在水中,NaCl的溶解度比I2的溶解度大 |
NaCl晶体中C1—与Na+间的作用力大于碘晶体中分子间的作用力 |
| C |
P4O10、C6H12O6溶于水后均不导电 |
P4O10、C6H12O6均属于共价化合物 |
| D |
通常条件下,CH4分子比PbH4分子稳定性高 |
Pb的原子半径比C的大,Pb与H之间的键能比C与H间的小 |