能源是人类生存和发展的重要支柱,研究化学反应过程中的能量变化在能源紧缺的今天具有重要的理论意义,已知下列热化学方程式
| ① |
H2(g)+ O2(g)= H2O(g) △H =﹣242kJ /mol; O2(g)= H2O(g) △H =﹣242kJ /mol; |
|||||||
| ② |
2H2(g)+ O2(g)= 2H2O(l) △H =﹣572kJ/mol; |
|||||||
| ③ |
C(s)+ O2(g)= CO(g) △H =﹣110.5kJ/moL; O2(g)= CO(g) △H =﹣110.5kJ/moL; |
|||||||
| ④ |
C(s)+ O2(g)= CO2(g) △H =﹣393.5kJ/moL; |
|||||||
| ⑤ |
CO2(g)+ 2H2O(g)= CH4(g)+ 2O2(g)△H =" +" 802kJ/moL |
|||||||
| 化学键 |
O=O |
C-C |
H-H |
O-O |
C-O |
O-H |
C-H |
|
| 键能kJ/mol |
497 |
348 |
436 |
142 |
351 |
463 |
414 |
|
则下列说法正确的是
A.H2燃烧热的热化学方程式为H2(g)+ O2(g)= H2O(g) △H =﹣242kJ /mol
O2(g)= H2O(g) △H =﹣242kJ /mol
B.热化学方程式:C(s)+ H2O(g) H2(g)+ CO(g) △H =" +" 175.5 kJ/moL
H2(g)+ CO(g) △H =" +" 175.5 kJ/moL
C.CH4的燃烧热△H ="—" 802 kJ/moL
D.估算出C=O键能为800kJ/moL
下列化学用语表示正确的是
| A.镓、锑的元素符号分别为Ge、Sb |
B.三氟化氮的电子式: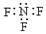 |
| C.次氯酸的结构式:H-O-Cl |
D.熔融状态下硫酸氢钾的电离方程式:KHSO4  K++H++SO42- K++H++SO42- |
化学与能源开发、环境保护、资源利用等密切相关。下列说法正确的是
| A.无论是风力发电还是潮汐发电,都是将化学能转化为电能 |
| B.光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅 |
| C.推广燃煤脱硫技术,可以防治SO2污染 |
| D.凡含有食品添加剂的食物对人体健康均有害,不宜食用 |
在温度、初始容积相同的3个密闭容器中,按不同方式投入反应物,发生如下反应:
3 X(g)+Y(g) x Z(g) ΔH<0
x Z(g) ΔH<0
保持温度不变,测得反应达到平衡时的有关数据如下:
| 恒容容器甲 |
恒容容器乙 |
恒压容器丙 |
|
| 反应物投入量 |
3 mol X 1 mol Y |
1.2 mol X 0.4 mol Y 1.2 mol Z |
3 mol X 1 mol Y |
| X的浓度(mol·L―1) |
c1 |
c2 |
c3 |
| Z的体积分数 |
φ1 |
φ2 |
φ3 |
| 体系压强(Pa) |
p1 |
p2 |
p3 |
下列说法中正确的是
A.若φ2=φ3,则x只能为2 B.若φ1=φ3,则x只能为4
C.若x=1,c2>1.6 c1D.若x=3,p2>0.8 p1
下列有关溶液中的离子反应及离子浓度大小表述正确的是
| A.中和相同体积、相同pH的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量相同 |
| B.在NaHCO3溶液中:c(H+)+c(H2CO3)=c(OH-) |
| C.在NaOH溶液中加入与其等物质的量的CH3COOH的过程中,始终有 c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
| D.将相同物质的量浓度的某弱酸(A-为弱酸根)溶液与KA溶液等体积混匀,测得混合后溶液pH=10,则混合液中c(K+)>c(A-) |
进行化学实验,观测实验现象,通过分析推理得出正确的结论是化学学习的方法之一。下列对有关实验事实的解释正确的是()
| A.SO2气体通入溴水(橙红色)褪色,表现了SO2的漂白性;足量的二氧化硫通入紫色石蕊试液中先变红后褪色,因为生成酸使其变红,又因为SO2的漂白性,使其褪色。 |
| B.浓硝酸在光照条件下变黄,说明浓硝酸易分解生成有色产物且溶于浓硝酸 |
| C.常温下,将铝片放入浓硫酸中,无明显现象,说明铝不与冷的浓硫酸反应 |
| D.向CuSO4溶液中加入一小块金属钠,则钠与Cu2+反应可置换出铜 |