太阳能的开发利用在新能源研究中占据重要地位,单晶硅太阳能电池片在加工时,一般掺杂微量的铜、锎、硼、镓、硒等.回答下列问題:
(1)二价铜离子的电子排布式为 。已知高温下Cu2O比CuO更稳定,试从铜原子核外电子结构变化角度解释 。
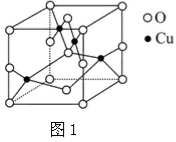
(2)如图1是铜的某种氧化物的晶胞结构示意图,可确定该晶胞中阴离子的个数为 。
(3)往硫酸铜溶液中加入过量氨水,可生成[Cu(NH3)4]2+配离子。已知NF3与NH3的空间构型都是三角锥形,但NF3不易与Cu2+形成配离子,其原因是:
(4)铜与类卤素(SCN)2反应生成Cu(SCN)2,1mol(SCN)2中含有π键的数目为 ,类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N )的沸点低于异硫氰酸(H﹣N=C=S)的沸点.其原因是 。
(5)硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,如BF3能与NH3反应生成BF3·NH3在BF3·NH3中B原子的杂化方式为 ,B与N之间形成配位键,氮原子提供 。
(6)六方氮化硼晶体结构与石墨晶体相似,层间相互作用为 。
六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构和硬度都与金刚石相似,晶胞边长为361.5pm,立方氮化硼的密度是 g/cm3。(只要求列算式)。
某小组同学利用下图装置(夹持仪器已省略)制备溴苯,并探究该反应原理。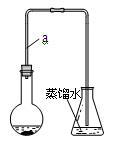
I.制备溴苯
(1)装置中长导管a的作用是 、导出气体。
(2)本实验所获得的溴苯为褐色,是因为 。
II.分离提纯
已知,溴苯与苯互溶,液溴、苯、溴苯的沸点依次为59℃、80℃、156℃。同学们设计了如下流程: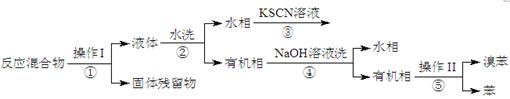
(3)操作Ⅱ为 。
(4)流程②和④中,需要用到的玻璃仪器是烧杯、 ;流程③的现象为 ,流程④的作用是 。
III.探究原理
(5)反应结束后,某同学取少量锥形瓶中的液体于试管中,再滴入几滴AgNO3溶液,出现浅黄色浑浊,从而判断反应一定生成了HBr。你认为该同学的判断 (填“合理”、“不合理”)。
(6)为探究锥形瓶中溶液的离子,请完成下表探究实验方案(限选试剂:镁粉、四氯化碳、氯水、溴水、蒸馏水)
| 实验步骤 |
预期现象 |
结论 |
| 1.将锥形瓶中的液体转入分液漏斗,加足量 ① ,振荡后分液。分别取少量 ② 层溶液于试管A、B中 |
||
| 2.向试管A中加入少量③和四氯化碳,振荡后静置; |
溶液分层,下层显 ④ 色 |
锥形瓶中液体含大量Br- |
| 3.向试管B中加入⑤ 。 |
有汽泡生成 |
锥形瓶中液体含大量 ⑥ |
根据上述结论推断,制备溴苯的反应属于 反应,其反应方程式为 。
A、B、C、D、E五种芳香化合物都是某些植物挥发油中的主要成分,有的是药物,有的是香料,它们的结构简式如下: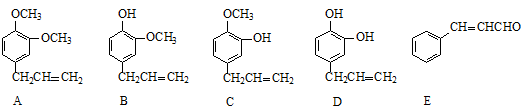
请回答下列问题:
(1)A的分子式为 ;这五种化合物中,互为同分异构体的是 (填序号)。
(2)若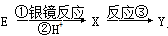 ,且Y是D的同分异构体,写出反应①的化学方程式: ,Y的结构简式为 ,反应③属于 反应。
,且Y是D的同分异构体,写出反应①的化学方程式: ,Y的结构简式为 ,反应③属于 反应。
已知乙烯能发生以下转化: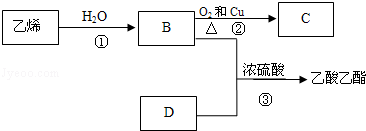
(1)乙烯的结构简式为:
(2)写出B、D化合物中官能团名称:B中含官能团 ;D中含官能团 ;
(3)写出反应的化学方程式
① 反应类型:
② 反应类型:
③ 反应类型:
充分燃烧1.4 g某有机物A生成4.4 gCO2和1.8 g H2O,该有机物蒸气的密度是相同条件下H2密度的28倍。
(1)该有机物的实验式为________,分子式为________。
(2)A的链状同分异构体共________种。
(3)A的链状同分异构体中含有支链的同分异构体的结构简式为________,其名称为________。
(4)B是A的某种同分异构体,B的磁共振氢谱中只有4个信号峰(即只有4种氢原子),B中官能团为_______(用化学式表示),B通入Br2的CCl4溶液褪色,生成化合物C。则由B生成C的化学方程式为______ __。
某有机物A的结构简式为: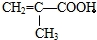 则:
则:
(1)该有机物含有的官能团为: 、 ;
(2)判断有机物A不可能发生的反应是下列中的: (填序号);
①加成反应 ②消去反应 ③氧化反应 ④酯化反应 ⑤加聚反应
(3)任写出一种符合下列条件的A的同分异构体:①能发生银镜反应;②与金属钠反应有气体产生 ;
(4)写出A与溴水反应的化学方程式: .