下列有关元素的性质或递变规律正确的是
| A.ⅠA族与ⅦA族元素间可形成共价化合物或离子化合物 |
| B.第三周期主族元素从左到右,氧化物对应的水化物酸性依次增强 |
| C.同主族元素的简单阴离子还原性越强,对应的简单氢化物沸点越高 |
| D.同周期金属元素的主族序数越大,其原子失电子能力越强 |
常温下,0.2 mol/L的一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是( )
| A.HA为强酸 | B.该混合液pH=7 |
| C.图中X表示HA,Y表示OH-,Z表示H+ | D.该混合溶液中:c(A-)+c(Y)=c(Na+) |
用电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和硫酸钠溶液一段时间,假设电解时温度不变且用惰性电极,下列说法不正确的是( )
| A.当电池负极消耗mg气体时,电解池阴极有mg气体生成 |
| B.电解池的阳极反应式为:4OH--4e-=2H2O+O2↑ |
| C.电解后,c(Na2SO4)不变,且溶液中有晶体析出 |
| D.电池中c(KOH)不变;电解池中溶液pH变大 |
某化工生产反应历程的能量变化如右图,过程I没有使用催化剂,过程Ⅱ使用了催化剂,则可判断催化剂除了能改变反应速率外,还可以改变的是( )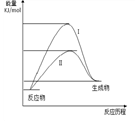
| A.反应物的状态 | B.反应的完成程度 | C.生产能耗 | D.反应热效应 |
下列关于元素及其化合物的说法正确的是()
| A.Fe在常温下可与浓硝酸、稀硝酸、浓硫酸剧烈反应 |
| B.Al、Cl2均能和NaOH溶液发生氧化还原反应,且两单质的作用相同 |
| C.Na久置于空气中,可以和空气中的有关物质发生反应,最终生成Na2CO3 |
| D.制备FeCl3、CuCl2固体均可采用将溶液直接蒸干的方法 |
用下列装置不能达到有关实验目的的是()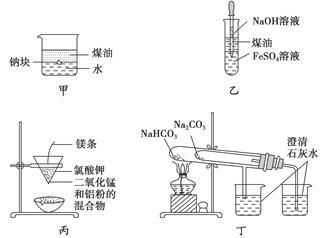
| A.用甲图装置证明ρ(煤油)<ρ(钠)<ρ(水) |
| B.用乙图装置制备Fe(OH)2 |
| C.用丙图装置制取金属锰 |
| D.用丁图装置比较NaHCO3和Na2CO3的热稳定性 |