Ⅰ(1)写出工业上电解饱和食盐水的化学反应方程式
(2)完成以下氧化还原反应的离子方程式
Fe2++ Cr2O72-+ = Fe3++ Cr3++
Ⅱ 水滑石是一类重要的阻燃剂。某研究小组为了探究一种碱式碳酸盐类水滑石M(仅含五种常见短周期元素,带结晶水,其摩尔质量为522 g·mol-1)的组成和性质,设计并完成如下实验:

取52.2g水滑石M进行上述实验,得到4.4g气体乙、15.6g白色沉淀2和23.2g白色沉淀3。
已知:气体甲常温常压下为无色无味液体。回答下列问题:
(1)写出气体乙的结构式 ,白色沉淀2的化学式 。
(2)在惰性气流中加热水滑石M至完全分解的化学方程式为 ,其能够阻燃的原因是_________________________________。
(3)固体1中的某种成分与Cl2、焦炭在一定条件下发生氧化还原反应,生成一种盐(可作净水剂)和常见的气体氧化物,写出一个可能的化学反应方程式 ,并设计实验确定气体产物的成分(假设Cl2已反应完全): 。
(12)某化学课外小组用右图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A(A下端活塞关闭)中。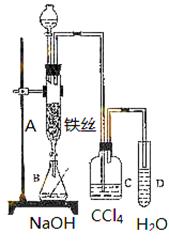
(1)A中铁丝发生如下反应2Fe+3Br2=2FeBr3,FeBr3的作用是,请写出A中另外一个反应的化学方程式。
(2)观察到 A中的气体颜色是由______色变成_______色。
A中的气体颜色是由______色变成_______色。
(3)实验结 束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是________________________________。
束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是________________________________。
(4)C中盛放CCl4的作用是____________________________。
(5)能证明苯和液溴发生的是取代反应,而不是加成反应的方法是验证是否有HBr的生成,故而可向试管D中滴入石蕊溶液,若溶液变红,则能 证明。另一种验证的方法是向试管D中加入__________,现象是__________________________________________。
证明。另一种验证的方法是向试管D中加入__________,现象是__________________________________________。
下列有关实验的叙述,正确的是(填序号)
| A.用98%的浓硫酸配制100g10%的稀硫酸溶液时,除使用量筒外还需用到容量瓶 |
| B.用渗析法分离淀粉中混有的NaNO3杂质 |
| C.无法用分液漏斗将乙二醇和水的混合液体分离 |
| D.用浓氨水洗涤做过银镜反应的试管 |
E.配制浓硫酸和浓硝酸的混合酸时,将浓硫酸沿器壁慢慢加入到浓硝酸中,并不断搅拌
F.用酸式滴定管量取20.00mL 0.1000mol/L的KMnO4溶液
G.用托盘天平称取10.50g干燥的NaCl固体
H.在中学《硫酸铜晶体里结晶水含量测定》的实验中,称量操作至少需要四次
I.用瓷坩埚高温熔融NaOH和Na2CO3的固体混合物
J.配制银氨溶液时,将稀氨水慢慢滴加到硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
31.某化学课外小组用右图装置制取溴苯。先向分液漏斗中加入苯和液溴,再将混合液慢慢滴入反应器A中(A下端活塞关闭)。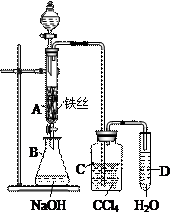
(1)写出A中反应的化学方程式:
(2)观察到A中的现象是:
(3)实验结束时,打开A下端的活塞,让反应液流入B中,充分振荡,目的是:
(4)C中盛放CCl4的作用是
(5)证明苯和液溴发生的是取代反应,而不是加成反应,可向试管D中加入AgNO3溶液,若产生淡黄色沉淀,则能证明。另一种验证的方法是向试管D中加入,现象是
现有36%的醋酸(CH3COOH),密度为1g/ml,欲配制0.1 mol/L的醋酸250 ml,需要取用36%的醋酸ml。需要使用的实验仪器有烧杯、量筒、玻璃棒、、
若配制时仅有其中一步操作(如图所示)有错误,其他操作全部正确,则所配醋酸的浓度 (填“正确”、“偏大”或“偏小”)。
(填“正确”、“偏大”或“偏小”)。
实验室用固体烧碱配制100 mL 1.0 mol·L-1的NaOH溶液。
| A.100 mL烧杯 | B.500 mL容量瓶 | C.玻璃棒 | D.100 mL容量瓶 E、漏斗 |
F、胶头滴管 G、试管 H、托盘天平 I、药匙 J、200 mL试剂瓶
(1)需称量_________ g 烧碱,应放在___________中(填写代号)称量、溶解。
(2)完成此配制实验,需要用的仪器(填写代号)___________________