将少量氯水加入KI溶液中,振荡,再加入CCl4,振荡,静置,观察到的现象是( )
| A.有紫黑色固体析出 | B.形成均匀的紫红色溶液 |
| C.液体分层,下层紫红色 | D.液体分层,上层紫红色 |
用如图所示实验装置(夹持仪器已略去)探究铜丝与过量浓硫酸的反应。下列实验不合理的是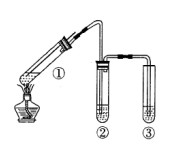
| A.上下移动①中铜丝可控制SO2的量 |
| B.②中选用品红溶液验证SO2的生成 |
| C.③中选用NaOH溶液吸收多余的SO2 |
| D.为确认CuSO4生成,向①中加水,观察颜色 |
高铁酸钠(Na2FeO4)是一种高效的饮用水处理剂,工业上可由下列方法制得:Fe2O3+3Na2O2 2Na2FeO4+Na2O
2Na2FeO4+Na2O
关于该反应说法正确的是
| A.反应中Na2O2是氧化剂 |
| B.Fe2O3可以通过铁丝在氧气中燃烧制得 |
| C.生成1 mol Na2FeO4,有6 mol电子转移 |
| D.在Na2FeO4中Fe为+4价,具有强氧化性,能消毒杀菌 |
在SiO2+3C SiC+2CO↑反应中,氧化剂和还原剂的质量比为
SiC+2CO↑反应中,氧化剂和还原剂的质量比为
| A.36:30 | B.60:36 | C.2:1 | D.1:2 |
某混合气体中可能含有Cl2、O2、SO2、NO、NO2中的两种或多种。若该气体为无色气体,且通过品红溶液后,品红溶液褪色,剩余气体与空气接触时,很快变为红棕色。下列判断正确的是
| A.肯定只有NO |
| B.肯定有SO2和O2 |
| C.可能有Cl2和O2 |
| D.肯定没有Cl2、O2和NO2 |
下列离子方程式不正确的是
| A.将一小粒金属钠放入水中:2Na+2H2O=2Na++2OH-+H2↑ |
| B.将氯气通入氢氧化钠溶液中:Cl2+2OH-=C1-+C1O-+H2O |
| C.向CuSO4溶液中加入适量Ba(OH)2溶液:Ba2++SO42-=BaSO4↓ |
| D.向稀硝酸中加人铜片:3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O |