下列事实能说明H2SO3不是强电解质的是
① 0.05 mol/L H2SO3 溶液的pH>1 , ②常温下Na2SO3溶液的pH>7 ,
③ H2SO3不稳定,易分解, ④H2SO3能与碳酸钠反应制CO2 ,
⑤ H2SO3能和水以任意比例互溶, ⑥ 1mol H2SO3能够消耗2 mol NaOH
| A.①②⑤ | B.①②④ | C.①②③⑤ | D.①② |
某温度下,已知反应mX(g)+ nY(g) 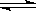 qZ(g)△H=" +Q" kJ·mol—1(Q>0),下列叙述正确的是()
qZ(g)△H=" +Q" kJ·mol—1(Q>0),下列叙述正确的是()
| A.反应达到最大限度时,加入X,反应的△H增大 | |
| B.在一定条件下向容器中放入m molX和n mol Y,充分反应吸收Q kJ的能量 | |
C.反应速率υ正(X) =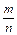 υ正(Y) υ正(Y) |
D.降低温度,反应的速率值变大 |
下列说法中有明显错误的是()
| A.对有气体参加的化学反应,增大压强,体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大 |
| B.活化分子之间发生的碰撞不一定为有效碰撞 |
| C.升高温度,一般可使活化分子的百分数增大,因而反应速率增大 |
| D.加入适宜的催化剂,使分子能量增加从而可使活化分子的百分数大大增加,从而成千上万倍地增大反应速率 |
在一密闭容器中进行下列反应:2SO2+O2 2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L,0.1mol/L,0.2mol/L,当反应达到平衡时,可能存在的数据是 ( )
2SO3(g),已知反应过程中某一时刻SO2、O2、SO3的浓度分别为0.2mol/L,0.1mol/L,0.2mol/L,当反应达到平衡时,可能存在的数据是 ( )
| A.SO2为0.4mol/L,O2为0.2mol/L | B.SO2为0.25mol/L |
| C.SO2,SO3均为0.15mol/L | D.SO3为0.4mol/L |
在密闭容器中有可逆反应nA (g)+mB(g)  pC(g)△H>0处于平衡状态(知n+m>p),下列说法正确的是()
pC(g)△H>0处于平衡状态(知n+m>p),下列说法正确的是()
①升高温度时,c(B)/c(C)的比值减小②降温时,体系内混合气体平均式量减小
③加入B,A的转化率变大④加入催化剂,气体的总物质的量不变
⑤充入C,则A,B的物质的量增大
A③④ B ①②⑤ C ②③⑤ D 全部
已知下列两个反应中:
4P(白磷,s)+5O2(g)=2P2O5(s)△H= -Q1 KJ/mol
4P(红磷,s)+5O2(g)=2P2O5(s)△H= -Q2 KJ/mol
且Q1>Q2,则不正确的是()
| A.燃烧白磷放出的能量比燃烧红磷放出的能量多 |
| B.白磷转化为红磷是属于放热反应 |
| C.白磷和红磷互为同素异形体 |
| D.等质量的白磷和红磷,白磷含有的能量比红磷的低 |