甲醇(CH3OH)和二甲醚(CH3OCH3)被称为21世纪的新型燃料,具有清洁、高效等优良的性能。
(1)CO2可用于合成二甲醚(CH3OCH3),有关反应的热化学方程式如下:
CO2(g) + 3H2(g) = CH3OH(g) + H2O(g) ΔH = -49.0kJ·mol-1,
2CH3OH(g) =CH3OCH3(g)+ H2O(g) ΔH =-23.5kJ·mol-1,
则CO2与H2反应合成二甲醚的热化学方程式为 。
(2)若反应2CH3OH(g)  CH3OCH3(g)+ H2O(g)在某温度下的化学平衡常数为400,此温度下,在密闭容器中加入一定量甲醇,反应进行到某时刻,测得各物质的浓度如表所示:
CH3OCH3(g)+ H2O(g)在某温度下的化学平衡常数为400,此温度下,在密闭容器中加入一定量甲醇,反应进行到某时刻,测得各物质的浓度如表所示:
| 物质 |
CH3OH(g) |
CH3OCH3(g) |
H2O(g) |
| 浓度(mol·L-1) |
0.44 |
0.60 |
0.60 |
①写出该反应的平衡常数表达式:K= 。
②比较该时刻正、逆反应速率的大小:v(正) v(逆)(填“>”、“<”或“=”)
③若加入甲醇后经 10 min 反应达到平衡,则平衡后c(CH3OH)= ,该时间内反应速率v(CH3OCH3)= 。
(3)工业上合成甲醇的反应:CO(g)+2H2(g) CH3OH(g) ΔH =-90.8kJ·mol-1,若在温度相同、容积均为2L的3个容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时如下:
CH3OH(g) ΔH =-90.8kJ·mol-1,若在温度相同、容积均为2L的3个容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时如下:
| 容器 |
甲 |
乙 |
丙 |
| 反应物投入量 |
1molCO、2 mol H2 |
1 mol CH3OH |
2 mol CO、4 mol H2 |
| CH3OH的浓度(mol/L) |
c1=0.25 |
c2 |
c3 |
| 反应的能量变化 |
放出Q1 kJ |
吸收Q2 kJ |
放出Q3 kJ |
| 平衡常数 |
K1 |
K2 |
K3 |
| 反应物转化率 |
α1 |
α2 |
α3 |
①下列不能说明该反应在恒温恒容条件下已达化学平衡状态的是 。
A. v正(H2)= 2v逆(CH3OH) B. n(CO)﹕n(H2)﹕n(CH3OH)=1﹕2 : 1
C. 混合气体的密度不变 D. 混合气体的平均相对分子质量不变
E. 容器的压强不变
②下列说法正确的是 。
A. c1= c2 B. Q1= Q2 C. K1= K2 D. α2+α3 < 100%
③如图表示该反应的反应速率v和时间t的关系图:

各阶段的平衡常数如下表所示:
| t2~t3 |
t4~t5 |
t5~t6 |
t7~t8 |
| K4 |
K5 |
K6 |
K7 |
K4、K5、K6、K7之间的关系为 (填“>”、“<”或“=”)。反应物的转化率最大的一段时间是 。
根据中和热的测定实验填空。
取0.55 mol/L的NaOH溶液50mL与0.5mol/L的盐酸50mL置于图3-4所示的装置中
进行反应和测定中和反应的反应热。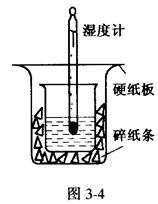
(1)图3-4装置缺少的一种仪器是____________,装置中还存在的错误有____________,这种错误会造成最高温度读数____________(填“增大”、“减小”或“无影响”)。
(2)大烧杯杯口若不盖硬纸板,测得的中和热的数值将____________(填“偏大”、“偏小”或“无影响”)。
(3)假定0.5mol/L的盐酸和0.55mol/L的NaOH溶液的密度都是 ,中和后生成溶液的比热容为C J/(g.℃)反应前的温度为18℃,反应后最高温度为t℃,则中和热的计算式是△H=________________________。
,中和后生成溶液的比热容为C J/(g.℃)反应前的温度为18℃,反应后最高温度为t℃,则中和热的计算式是△H=________________________。
(4)实验中,若改用60mL 0.5mol/L的盐酸进行实验,与上述实验结果相比,则放出的热量____________(填“增多”、“减小”或“相等”),测得的中和热____________
(填“相同”或“不相同”)。
有一无色透明溶液,欲确定是否含有下列离子: K+、Mg2+、A13+、Ba2+、NO3--、SO42-、CI--、Fe2+ HCO3--.取该溶液实验如下:
| 实验步骤 |
实现现象 |
| (1)取少量该溶液,加几滴甲基橙 |
溶液变红色 |
| (2)取少量该溶液加热浓缩,加Cu片和浓H2SO4,加热 |
有无色气体产生,气体遇空气中以变成红棕色 |
| (3)取少量该溶液,加BaCI2溶液 |
有白色沉淀生成 |
| (4)取(3)中上层清液,加AgNO3溶液 |
有稳定的白色沉淀生成,且不溶于HNO3 |
| (5)取少量该溶液,加NaOH溶液 |
有白色沉淀生成,当NaOH过量时沉淀部分溶解 |
由此判断:
(1)溶液中肯定存在的离子是 ,溶液中肯定不存在的离子是 。
(2) 写出(3)中生成沉淀的离子方程式 。
写出(5)中沉淀部分溶解的离子方程式 。
(3)为进一步确定其他离子.应该补充的实验及 对应欲检离子的名称(如为溶液反应,说明使用试剂的名称。不必写详细操作步骤) ;
已知A、B、C、D分别是Na2SO3、HCl、BaCl2、AgNO3四种物质的水溶液中的某一种,将它们两两混合反应的情况如下:
注:↓表示生成沉淀,↑表示生成气体,/表示不反应。
| A |
B |
C |
D |
|
| A |
↓ |
↓ |
∕ |
|
| B |
↓ |
↓ |
↑ |
|
| C |
↓ |
↓ |
↓ |
|
| D |
∕ |
↑ |
↓ |



 ①写出A、B、C、D的化学式A B C D
①写出A、B、C、D的化学式A B C D ②写出A与C反应的离子方程式
②写出A与C反应的离子方程式 写出B与D反应的离子方程式
写出B与D反应的离子方程式
在淀粉-KI溶液中滴入少量NaClO溶液,并加入少量硫酸,溶液立即变蓝,这是因为⑴___________________________,离子方程式:____________________________;⑵在上述蓝色溶液中滴加足量的Na2SO3溶液,蓝色逐渐消失,这是因为_______________,离子方程式是__________________________________。⑶从以上实验可知ClO-、I2、SO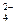 的氧化性由强到弱的顺序是________________________。
的氧化性由强到弱的顺序是________________________。
根据中和热的测定实验填空。
取0.55 mol/L的NaOH溶液50mL与0.5mol/L的盐酸50mL置于图3-4所示的装置中
进行反应和测定中和反应的反应热。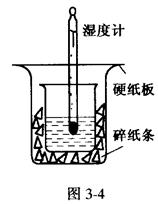
(1)图3-4装置缺少的一种仪器是____________,装置中还存在的错误有____________,这种错误会造成最高温度读数____________(填“增大”、“减小”或“无影响”)。
(2)大烧杯杯口若不盖硬纸板,测得的中和热的数值将____________(填“偏大”、“偏小”或“无影响”)。
(3)假定0.5mol/L的盐酸和0.55mol/L的NaOH溶液的密度都是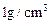 ,中和后生成溶液的比热容为C J/(g.℃)反应前的温度为18℃,反应后最高温度为t℃,则中和热的计算式是△H=________________________。
,中和后生成溶液的比热容为C J/(g.℃)反应前的温度为18℃,反应后最高温度为t℃,则中和热的计算式是△H=________________________。
(4)实验中,若改用60mL 0.5mol/L的盐酸进行实验,与上述实验结果相比,则放出的热量____________(填“增多”、“减小”或“相等”),测得的中和热____________
(填“相同”或“不相同”)。