工业上常用FeCl3溶液与铜反应制作印刷电路板。该反应的化学方程式为:2FeCl3+Cu =2FeCl2+CuCl2。取上述反应后溶液10 mL进行分析,测得其中c(Fe3+)为1mol·L—1。向其中加入足量的硝酸银溶液,过滤、干燥,可得到沉淀l7.22g。则上述反应后的10mL溶液中c(Cu2+)为
| A.0.5mol·L—1 | B.1.5 mol·L—1 | C.0.4 mol·L—1 | D.0.25 mol·L—1 |
下列有机物的命名中,正确的是
| A.2,2—二甲基丁烷 | B.3,3—二甲基丁烷 |
| C.2—乙基丁烷 | D.2,3,3—三甲基丁烷 |
将一定量铁粉和铜粉的混合物加入由稀H2SO4和HNO3组成的混合溶液中,充分反应后金属粉末有剩余,下列有关推断正确的是
| A.反应过程中不可能产生H2 |
| B.剩余的金属粉末中一定有铜 |
| C.往反应后的溶液中加入KSCN溶液会变血红色 |
| D.往反应后的溶液中加入足量的稀H2SO4,则金属粉末的质量一定会减少 |
用试纸检验气体性质是一种重要的实验方法。如下图所示的实验中(可加热),下列试纸的选用、现象、对应结论都正确的一项是
| 选项 |
试剂B |
湿润的试纸A |
现象 |
结论 |
| A |
碘水 |
淀粉试纸 |
变蓝 |
碘具有氧化性 |
| B |
浓氨水,生石灰 |
蓝色石蕊试纸 |
变红 |
氨气为碱性气体 |
| C |
Na2SO3,硫酸 |
品红试纸 |
褪色 |
SO2具有漂白性 |
| D |
Cu,浓硝酸 |
淀粉一KI试纸 |
变蓝 |
NO2为酸性气体 |
将4 mol A气体和2 mol B气体在2L的容器中混合并在一定条件下发生如下反应:2A(g)+B(g) 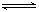 2C(g)若经2s 后测得C的浓度为0.6mol•L-1现有下列几种说法其中不正确的是
2C(g)若经2s 后测得C的浓度为0.6mol•L-1现有下列几种说法其中不正确的是
| A.用物质A表示的反应的平均速率为0.3 mol•L-1•s-1 |
| B.2s时的压强是起始时的1.1倍 |
| C.2s时物质A的转化率为30% |
| D.2s时物质B的浓度为0.7 mol•L-1 |
图中曲线表示元素周期表前20号元素中的某些元素的原子序数(按递增顺序连续排列)及其常见最高化合价的关系,其中A点表示的元素是
| A.Si | B.Al | C.O | D.N |