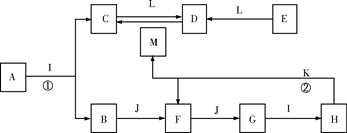
(除标注外,每空2分,共8分)如下图所示:化合物A只含两种元素,C为白色胶状沉淀,B、F为刺激性气体,且F能使品红溶液褪色,E为金属单质,J、K为非金属单质,化合物H和L为常见化工产品,化合物I常温下为液态,H的浓溶液与K加热能生成F和无色无味气体M(图中反应条件和部分产物已略去)。
试回答下列问题:
(1)写出A、M的化学式:A_____;M__ _。
(2)写出反应①、②的化学方程式:
__ __;_ _ _。
(3)写出E→D反应的离子方程式:_ __。
(12分)高分子材料E和含扑热息痛高分子药物的合成流程如图所示: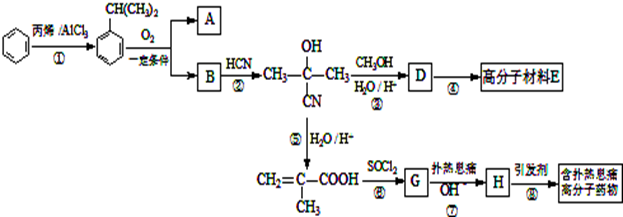
已知:I.含扑热息痛高分子药物的结构为: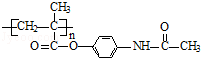
II.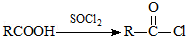
III.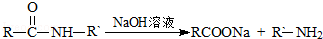
试回答下列问题:
(1)①的反应类型为,G的分子式为。
(2)若1mol 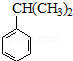 可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式:;
可转化为1mol A和1mol B,且A与FeCl3溶液作用显紫色,写出A的稀溶液与过量浓溴水发生反应的化学方程式:;
(3)反应②为加成反应,则B的结构简式为;扑热息痛的结构简式为。
(4)D蒸气密度是相同状态下甲烷密度的6.25倍,D中各元素的质量分数分别为碳60%,氢8%,氧32%.D分子中所含官能团为。
(5)1mol含扑热息痛高分子药物最多可与(含NaOH___mol)氢氧化钠溶液发生反应。
[化学一选修5:有机化学基础]
聚戊二酸丙二醇酯(PPG)是一种可降解的聚酯类高分子材料,在材枓的生物相存性方面有很好的应用前景。 PPG的一种合成路线如下:
已知:
①烃A的相对分子质量为70,核磁共振氢谱显示只有一种化学环境的氢;
②化合物B为单氯代烃:化合物C的分子式为C5H8;
③E、F为相对分子质量差14的同系物,F是福尔马林的溶质;
④ 。
。
回答下列问题:
(1)A的结构简式为。
(2)由B生成C的化学方8式为 。
(3)由E和F生成G的反应类型为,G的化学名称为 。
(4) ①由D和H生成PPG的化学方程式为。
②若PPG平均相对分子质量为10000,则其平均聚合度约为(填标号).
a. 48 b. 58 c. 76 d.122
(5)D的网分异构体中能同时满足下列条件的共有种(不含立体异构):
①能与饱和NaHCO3溶液反应产生气体②既能发生银镜反应,又能发生皂化反应
其中核磁共振氢谱显示为3组峰,且峰面积比为6:1:1的是(写姑构简式):
D的所有同分异构体在下列—种表征仪器中显示的信号(或数据)完全相同,该仪器是
___________(填标号)。
a.质谱仪 b.红外光谱仪c.元素分析仪d.核磁共振仪
[化学---有机化学基础]
菠萝酯F是一种具有菠萝香味的赋香剂,其合成路线如下: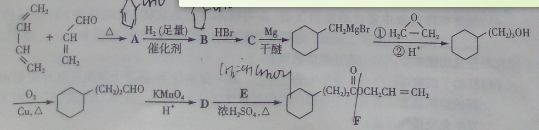
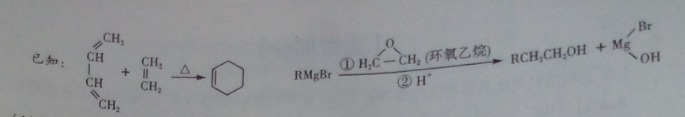
(1)A的结构简式为_________________,A中所含官能团的名称是_________。
(2)由A生成B的反应类型是______________,E的某同分异构体只有一种相同化学环境的氢,该同分异构体的结构简式为_________________。
(3)写出D和E反应生成F的化学方程式________________________。
(4)结合题给信息,以溴乙烷和环氧乙烷为原料制备1-丁醇,设计合成路线(其他试剂任选)。
已知①酯交换反应:R1COOR2+ R3OH → R1COOR3 + R2OH(R1,R2,R3代表烃基) 。
②同一个碳上不能同时连碳碳双键和羟基。 ③CH3COOH + CH2=CH2 → CH3COOCH2CH3
苯和丙烯都是重要的化工原料。在不同条件下,苯与丙烯发生原子利用率为100%的反应,通过如下路线合成 、PTT和DAP等化工产品。
、PTT和DAP等化工产品。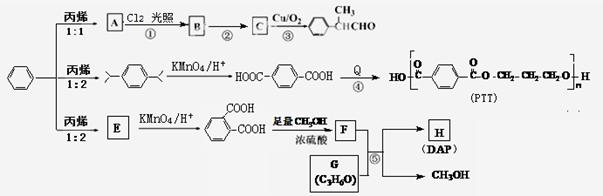
回答下列问题:
(1)A的结构简式是,Q的名称是。
(2)反应②的化学方程式是。
(3)F的同分异构体有多种,同时满足下列条件的F的所有稳定的同分异构体有种。
①苯环上有2个处于对位的取代基且属于酚类;
②能与小苏打溶液反应并放出气体;
③能发生银镜反应。
(4)反应⑤的化学方程式为。用G和F反应来合成H,而不是用G和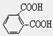 直接反应,原因是。
直接反应,原因是。
(5)若Q能与碳酸二甲酯( )发生酯交换反应,生成一种高分子化合物M和甲醇,写出M的结构简式。
)发生酯交换反应,生成一种高分子化合物M和甲醇,写出M的结构简式。
【化学—选修5有机化学基础】石油化工的重要原料CxHy可以合成很多有机化合物,以下是CxHy合成物质E和J的流程图: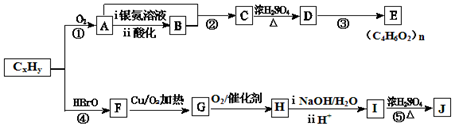
已知:Ⅰ.下列反应中R、R′代表烃基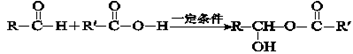
Ⅱ.J的分子式为C4H4O4 ,是一种环状化合物。
(1)在CxHy的同系物中,所有碳原子一定共平面且碳原子数最多的分子的名称是____。
(2)H的分子式是。
(3)下列说法正确的是。
a.CxHy和苯都能使溴水褪色,原理相同
b.反应②和反应④的反应类型均为加成反应
c.C能与Na、NaOH、NaHCO3反应
d.E是一种水溶性很好的高分子化合物
e.J在酸性或碱性环境中均能水解
(4)K是J的同分异构体,且1 mol K与足量的NaHCO3溶液反应可放出2mol CO2气体,请写出两种符合条件K的结构简式____。
(5)写出反应⑤的化学方程式______________。
(6)D有多种同分异构体,与D具有相同官能团的还有种(含顺反异构体),其中核磁共振氢谱有3组吸收峰,且能发生银镜反应的结构简式是__________。