下列离子方程式正确的是
| A.向硫酸铝铵溶液中滴加少量Ba(OH)2溶液:NH+Al3++2SO+2Ba2++5OH-=AlO+2BaSO4↓+NH3·H2O+2H2O |
| B.工业上用石灰乳制备漂白粉:Ca(OH)2+Cl2=Ca2++ClO-+Cl-+ H2O |
C.制备Fe(OH)3胶体: Fe3++3H2O  Fe(OH)3(胶体)+3H+ Fe(OH)3(胶体)+3H+ |
| D.用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性: |
2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O
下列各组热化学方程式中,化学反应的△H前者大于后者的是()
①C(s)+O2(g) CO2(g); △H1 C(s)+1/2O2(g)
CO2(g); △H1 C(s)+1/2O2(g) CO(g); △H2
CO(g); △H2
②S(s)+O2(g)  SO2(g); △H3 S(g)+O2(g)
SO2(g); △H3 S(g)+O2(g)  SO2(g); △H4
SO2(g); △H4
③H2(g)+1/2O2(g) H2O(l); △H5 2H2(g)+O2(g)
H2O(l); △H5 2H2(g)+O2(g) 2H2O(l); △H6
2H2O(l); △H6
④CaCO3(s) CaO(s)+CO2(g);△H7 CaO(s)+H2O(l)
CaO(s)+CO2(g);△H7 CaO(s)+H2O(l) Ca(OH)2(s);△H8
Ca(OH)2(s);△H8
| A.① | B.④ | C.②③④ | D.①②③ |
已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示,下列说法正确的是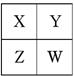
| A.W的原子序数可能是Y的原子序数的2倍 |
| B.X可能为氢元素 |
| C.W的气态氢化物的稳定性一定比Y的强 |
| D.X、Y、Z、W四种元素的最外层电子数之和可能为25 |
下列各组物质中化学键的类型完全相同的是()
| A.HCl、MgCl2 | B.H2O、Na2O | C.CaCl2 、NaOH | D.NH3、CO2 |
下列关于元素周期表和元素周期律的说法不正确的是( )
| A.从氟到碘,单质的氧化性逐渐减弱,氢化物的还原性逐渐增强 |
| B.等物质的量的钠原子比铝原子失去的电子数少,所以钠比铝的还原性弱 |
| C.从钠到氯,最高价氧化物的水化物碱性逐渐减弱,酸性逐渐增强 |
| D.氧与硫为同主族元素,氧比硫的原子半径小,氧气比硫的氧化性强 |
下列关于指定粒子构成的几种描述中不正确的是( )
| A.37Cl与39K具有相同的中子数 |
B.第114号元素的一种核素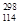 X与82Pb具有相同的最外层电子数 X与82Pb具有相同的最外层电子数 |
| C.H3O+与OH-具有相同的质子数和电子数 |
D.O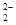 和S2-具有相同的质子数和电子数 和S2-具有相同的质子数和电子数 |