将一定质量的镁铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3 mol·L-1 NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是
| A.加入合金的质量不可能为5 g |
| B.参加反应的硝酸的物质的量为0.1 mol |
| C.沉淀完全时消耗NaOH溶液的体积为150 mL |
| D.溶解合金时收集到NO气体的体积在标准状况下约为2.24 L |
下列各溶液中能大量共存的离子组是
| A.碳酸氢钠溶液中:K+、SO42-、Cl-、H+ |
| B.使pH试纸呈红色的溶液中:Fe2+、I-、NO3-、Cl- |
| C.使酚酞试液呈红色的溶液中:Mg2+ Cu2+、SO42-、K+ |
| D.C(H+)=10-14mol/L的溶液中:Na+、AlO2-、S2-、SO42- |
俗称“一滴香”的有毒物质被人食用后会损伤肝脏,还能致癌。“一滴香”的分子结构如图所示,下列说法正确的是
| A.该有机物的分子式为C7H7O3 |
| B.该有机物能发生取代、加成和氧化反应 |
| C.1 mol该有机物最多能与2 molH2发生加成反应 |
| D.该有机物的一种芳香族同分异构体能发生银镜反应 |
设NA为阿伏加德罗常数的值,下列叙述正确的是
| A.在0.1 mol NaHSO4晶体中阳离子与阴离子总数为0.3 NA |
| B.25℃时,pH=13的1.0 LBa(OH)2溶液中含有的OH-数目为0.2 NA |
| C.常温常压下,4. 4gCO2和N2O混合物中所含有的原子数为0.3 NA |
| D.标准状况下,2. 24LCl2通入足量H2O或NaOH溶液中转移的电子数均为0.1 NA。 |
在密闭容器中存在如下反应:2SO2(g)+O2(g) 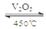 2SO3(g) ΔH<0,某研究小组研究其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是()
2SO3(g) ΔH<0,某研究小组研究其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是() 
| A.图Ⅰ表示的是t1时刻增大压强对反应速率的影响 |
| B.图Ⅱ表示的是t1时刻加入催化剂后对反应速率的影响 |
| C.图Ⅲ表示的是催化剂对平衡的影响,且甲的催化效率比乙高 |
| D.图Ⅲ表示的是压强对化学平衡的影响,且乙的压强较高 |
下图是部分短周期元素原子(用字母表示)最外层电子数与原子序数的关系图。
下列说法正确的是()
| A.X和R在同一周期 |
| B.原子半径:W>R>X |
| C.气态氢化物的稳定性:Y>X |
| D.X、Z形成的化合物中可能含有共价键 |