四位同学在学习“化学反应速率和化学平衡”后,联系工业生产实际所发表的观点,你认为不正确的是
| A.化学反应速率理论是研究怎样在一定时间内快出产品 |
| B.化学平衡理论是研究怎样使用有限原料多出产品 |
| C.化学反应速率理论是研究怎样提高原料转化率 |
| D.化学平衡理论是研究怎样使原料尽可能多地转化为产品 |
体积为1 L的干燥容器中充入HCl气体后,测得容器中气体对氧气的相对密度为1.082。将此气体倒扣在水中,进入容器中液体的体积大约是()
| A.0.25 L | B.0.5 L | C.0.75 L | D.1 L |
将0.4gNaOH和1.06g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-l的盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是()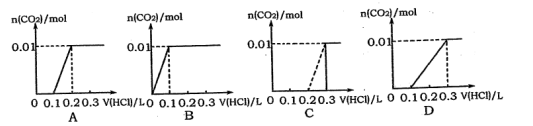
在一定体积的容器中加入1.5mol氙气(Xe)和7.5mol氟气,于400℃和2633kPa压强下加热数小时,然后迅速冷却至25℃,容器内除得到一种无色晶体外,还余下4.5mol氟气,则所得无色晶体产物中,氙与氟的原子个数之比是()
| A.1∶2 | B.1∶3 | C.1∶4 | D.1∶6 |
有BaCl2和NaCl的混合溶液a L,将它均分成两份。一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl- 完全沉淀。反应中消耗x mol H2SO4、y mol AgNO3。据此得知原混合溶液中的c(Na+)为()( mol·L-1)
| A.(y – 2x)/a | B.(y – x)/a | C.(2y – 2x)/a | D.(2y – 4x)/a |
超导材料为具有零电阻及反磁性的物质,以Y2O3、BaCO3和CuO为原料、经研磨烧结可合成一种高温超导物YBa2Cu3Ox,现欲合成0.5 mol此高温超导物,依化学剂量比例,需取Y2O3、BaCO3和CuO的物质的量分别为()
| A.0.50,0.50,0.50 | B.0.25,1.0,1.5 |
| C.0.50,1.0,1.5 | D.1.0,0.25,0.17 |