某学生欲用电解纯净CuSO4溶液的方法来测定铜的相对原子质量。其实验过程如图所示:
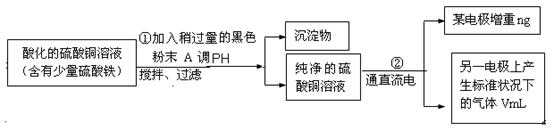
(1)步骤①所加的A的化学式为 ;已知:常温下Fe(OH)3的溶度积Ksp=8.0×10-38,Cu(OH)2的溶度积Ksp=3.0×10-20,通常认为残留在溶液中的离子浓度小于1×10-5 mol·L-1时就认为沉淀完全,设溶液中CuSO4的浓度为3.0 mol·L-1,则加入A调pH范围是_____ ___ (已知lg2=0.3)
(2)步骤②中所用的部分仪器如右图:则A应接在直流电源的 极(填“正”或“负” )。

(3)石墨电极上的电极反应式 。
(4)下列实验操作中必要的是(填字母) 。
| A.称量电解前电极的质量 |
| B.电解后,电极在烘干称重前,必须用蒸馏水冲洗 |
| C.刮下电解后电极上析出的铜,并清洗、称重 |
| D.电极在烘干称重的操作中必须按“烘干→称重→再烘干→再称重”进行 |
E.在有空气存在的情况下,烘干电极必须采用低温烘干的方法
(5)铜的相对原子质量为 (用带有n、V的计算式表示)。
(6)若②用甲醇—O2—熔融碳酸盐电池提供电能,写出该电池负极的电极反应式
某研究性学习小组为探究纯铁与盐酸反应,取同质量、同体积的锌片、同浓度盐酸做了下列平行实验: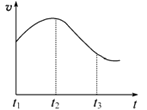
实验①:把纯铁片投入到盛有稀盐酸的试管中,发现氢气发生的速率变化如图所示:
实验②:在盐酸中滴入几滴CuCl2溶液,生成氢气速率加快。
试回答下列问题:
(1)试分析实验①中t1~t2速率变化的主要原因是 ,t2~t3速率变化的主要原因是。
(2)若要加快化学反应速率,除实验②的方法外,还可以采取哪些措施?(至少写两点)
、
(3)某同学认为实验②反应速率加快的主要原因是因为形成了原电池,你认为是否正确?
(填“正确”或“不正确”)。请选择下列相应的a或b作答。
a、若不正确,请说明原因:
b、若正确则写出实验②中原电池的正、负极电极反应式。
(4)已知热化学方程式Fe(S) + 2H+ (aq) = Fe2+(aq) + H2(g)↑ ; △H= —42kJ/mol,28g的铁完全反应后放出的热量为。
短周期元素的单质X、Y、Z在通常状况下均为气态,并有下列转化关系(反应条件略去):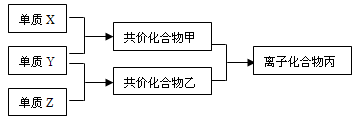
已知:a、常见双原子单质分子中,X分
子含共用电子对数目最多。b、甲分子含
10个电子,且能使湿润的红色石蕊试纸
变蓝,乙分子含18个电子。
(1)X的结构式:;丙的电子式:
(2)实验室可用下图所示装置(缺少收集装置,夹持固定装置略去)制备并收集甲。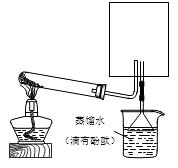
①在图中方框内绘出用烧瓶收集甲的仪器装置简图。
②试管中发生反应的化学方程式是:
③烧杯中溶液由无色变为红色,其原因是:(用电离方程式表示)
下表是元素周期表的一部分,针对表中的①~⑩中元素,填写下列空格:
| ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
| 2 |
① |
② |
③ |
④ |
||||
| 3 |
⑤ |
⑥ |
⑦ |
⑧ |
⑨ |
⑩ |
(1)在这10种元素中,化学性质最不活泼的元素是(填元素符号),金属性最强的元素是(填元素名称),最活泼的非金属单质是(化学式),元素⑨对应的离子结构示意图为_。
(2)给出的第二周期的几种元素中,原子半径最大的是(填元素符号)。
(3)元素③与⑧的气态氢化物中较稳定的物质是(填该物质的电子式)。
(4)元素⑤与⑥的最高价氧化物的水化物中,碱性较强的物质是(填化学式)。
(5)元素③与⑦能以键(填化学键类型)结合成晶体(填晶体类型)。
(6分)下列物质中,互为同分异构体的是______________;互为同素异形体的是______________;属于同位素的有______________;属于同一种物质的是______________。互为同系物的是
①35Cl ②白磷 ③37Cl ④红磷⑤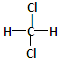 ⑥
⑥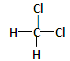
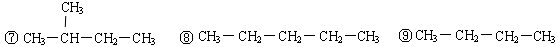
在如图所示的装置中,若通入直流电5min时,铜电极质量增加2.16 g,试回答:
(1) 电源电极X为________极。
(2) pH变化:A________,B________,C________。(填“增大”、“减小”或“不变”)
(3) 通电5 min时,B中共收集224 mL气体(标准状况),溶液体积为200 mL。则通电前CuSO4溶液的物质的量浓度为________(设电解前后溶液体积无变化)。
(4) 若A中KCl溶液的体积也是200 mL,电解后,溶液的pH为________(设电解前后溶液体积无变化)。