如图,a曲线是298 K、101 kPa时N2与H2反应过程中能量变化的曲线图,下列叙述正确的是
A.该反应的热化学方程式为:N2+3H2 2NH3 ΔH=-92 kJ·mol-1 2NH3 ΔH=-92 kJ·mol-1 |
| B.b曲线是升高温度时的能量变化曲线 |
| C.加入催化剂,该化学反应的反应热改变 |
| D.在298 K、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ则184>Q2>2Q1 |
在体积为VL的恒容密闭容器中盛有一定量H2,通入Br2(g)发生反应:H2(g)+Br2(g) 2HBr(g);△H<0.当温度分别为T1、T2达平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法不正确的是
2HBr(g);△H<0.当温度分别为T1、T2达平衡时,H2的体积分数与Br2(g)的物质的量变化关系如图所示.下列说法不正确的是
| A.a、b两点的反应速率:b>a |
| B.T1>T2 |
| C.T1时,随着Br2(g)加入,平衡时HBr的体积分数不断增加 |
| D.为了提高Br2(g)的转化率,可采取将HBr液化并及时移走的方法 |
气态PCl5的分解反应为2PCl5(g) 2PCl3(g)+2Cl2(g),在473K达到平衡时气态PCl5有48.5%分解,在573K达到平衡时气态PCl5有97%分解,则此反应是
2PCl3(g)+2Cl2(g),在473K达到平衡时气态PCl5有48.5%分解,在573K达到平衡时气态PCl5有97%分解,则此反应是
| A.放热反应 |
| B.吸热反应 |
| C.反应的焓变为零的反应 |
| D.无法判断是吸热反应还是放热反应 |
已知反应:2SO2(g)+O2(g) 2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)、温度(T)等条件的变化关系如下图所示.则下列说法正确的是
2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)、温度(T)等条件的变化关系如下图所示.则下列说法正确的是
| A.由图甲知,A点SO2的平衡浓度为0.4 mol/L |
| B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2 |
| C.压强为0.50 MPa时不同温度下SO2转化率与温度关系如图乙,则T2>T1 |
| D.达平衡后,缩小容器容积,则反应速率变化图象可以用图丙表示 |
已知:CO(g)+Cl2(g) COCl2(g)△H<0,当反应达到平衡时,下列措施中能提高Cl2转化率的是①升温 ②降温 ③增加CO浓度 ④加压 ⑤加催化剂 ⑥恒压通入惰性气体
COCl2(g)△H<0,当反应达到平衡时,下列措施中能提高Cl2转化率的是①升温 ②降温 ③增加CO浓度 ④加压 ⑤加催化剂 ⑥恒压通入惰性气体
| A.①④⑤ | B.②③④ | C.②④⑤ | D.③⑤⑥ |
如图所示可逆反应:mA(g)+nB(g) xC(g),△H="Q" kJ/mol,在不同温度、压强下反应物A的转化率的变化情况.下列对于反应的热效应Q和反应方程式A、B、C的化学计量数的判断中,正确的是
xC(g),△H="Q" kJ/mol,在不同温度、压强下反应物A的转化率的变化情况.下列对于反应的热效应Q和反应方程式A、B、C的化学计量数的判断中,正确的是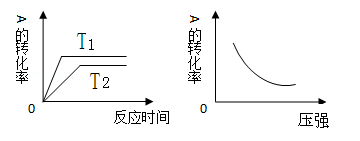
A.Q<0,m+n<x B.0,m+n>x
C.Q>0,m+n<x D.Q>0,m+n>x