周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a是宇宙中最丰富的元素,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同族,e的最外层只有1个电子,但次外层有18个电子。回答下列问题:
(1)b、c、d中第一电离能的大小顺序是 (填元素符号),e的价层电子轨道示意图为 。
(2)c的氢化物与d的氢化物的沸点大小顺序是 ;(填化学式)原因是
(3)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为 ;以上元素形成的分子中既含有极性共价键,又含有非极性共价键的化合物是 、 (填化学式,写出两种)。
(4)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸 ;(填化学式)酸根呈三角锥结构的酸是 。(填化学式)
(5) e和c形成的一种离子化合物的晶体晶胞结构如图1,则e离子的电荷为 ;其中c离子的配位数是 ;若已知该晶胞的边长为a pm,阿伏伽德罗常数为NA,则该晶胞的密度为 g/cm3.

铅蓄电池是典型的可充电电池,它的正负极格板是惰性材料,电池总反应式为:
Pb+PbO2+4H++2SO42—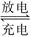 2PbSO4+2H2O
2PbSO4+2H2O
请回答下列问题(不考虑氢、氧的氧化还原):
放电时:正极的电极反应式是______________________________;电解液中H2SO4的浓度将变________;当外电路通过1 mol电子时,理论上负极板的质量增加________g。
如下图所示,可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为硫酸时)和碱式〔当电解质溶液为NaOH(aq)或KOH(aq)时〕两种。试回答下列问题: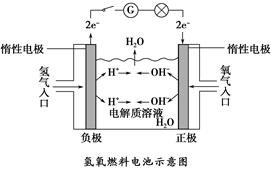
(1)酸式电池的电极反应:负极_______________,正极______________;电池总反应:________________;
电解质溶液pH的变化________(填“变大”“变小”或“不变”)。
(2)碱式电池的电极反应:负极_________________,正极_________________;电池总反应:______________;电解质溶液pH的变化________(填“变大”“变小”或“不变”)。
燃料电池是目前正在探索的一种新型电池。它主要是利用燃料在燃烧过程中把化学能直接转化为电能,目前已经使用的氢氧燃料电池的基本反应是
x极:O2(气)+2H2O(液)+4e-=4OH-
y极:H2(气)+2OH--2e-=2H2O(液)
回答下列问题:
(1)x是________极,发生________反应。(填“氧化”或“还原”,下同)
(2)y是________极,发生________反应。
总反应方程式为______________________。
(3)若反应后得到5.4 g液态水,此时氢氧燃料电池转移的电子数为________。
ZnMnO2干电池应用广泛,其电解质溶液是ZnCl2NH4Cl混合溶液。
(1)该电池的负极材料是________。电池工作时,电子流向________(填“正极”或“负极”)。
(2)若ZnCl2NH4Cl混合溶液中含有杂质Cu2+,会加速其电极的腐蚀,其主要原因是______________________________________________。
欲除去Cu2+,最好选用下列试剂中的________(填代号)。
| A.NaOH | B.Zn | C.Fe | D.NH3·H2O |
(1)将锌片和银片浸入稀硫酸中组成原电池,两电极间连接一个电流计。
锌片上发生的电极反应______________________________________
银片上发生的电极反应______________________________________
(2)若该电池中两电极的总质量为60 g,工作一段时间后,取出锌片和银片洗净干燥后称重,总质量为47 g,试计算:
①产生氢气的体积(标准状况);②通过导线的电量。(已知NA=6.02×1023 mol-1,电子电荷为1.60×10-19 C)