等质量的两种金属粉末A、B分别与同浓度的足量稀盐酸反应,都生成+2价金属氯化物,其反应情况如图所示:
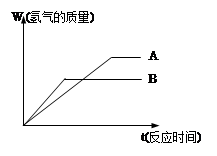
(1) 两种金属的活动性顺序是_____>______
两种金属氯化物的摩尔质量是_____>______
(2) 将两种金属粉末按一定比例混合后,进行甲、乙 丙三组实验,三组实验各取500mL同浓度的盐酸溶液加入该种混合粉末,产生气体,有关数据如下:
实验序号 甲 乙 丙
混合粉末质量(g) 6.2 18.6 24.8
生成气体气体(mL) 2240 5600 5600
①乙组实验中,盐酸________(填“过量”、“适量”或“不足量”)
②上述所用的盐酸的物质的量浓度为_________mol/L,混合粉末的平均摩尔质量是________。
A、B、C、D四种短周期元素,原子序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,B与C的单质在加热条件下反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上的电子数之和
(1)写元素符号:A为 ,C为 ,D的最高价氧化物的水化物化学式是。
(2)写出A、B形成的化合物与E反应的化学方程式:
(3)E属于(“离子”或“共价”)化合物。
(4)C与D两元素可形成化合物。
下表是周期表中的一部分,根据a—n在周期表中的位置,按要求回答问题:
| ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
| 1 |
a |
|||||||
| 2 |
b |
c |
d |
e |
||||
| 3 |
f |
g |
h |
i |
j |
k |
m |
n |
(1)表中元素,只有负价而无正价的元素是,氧化性最强的单质是。(本小题均填物质的名称)
(2)最高价氧化物的水化物中碱性最强的是,呈两性的是,写出它与氢氧化钠反应的离子方程式 。(本小题均用化学式表示)
(3)在b、c、d、f、g、h中,原子半径从大到小的顺序为的是。(用元素符号表示)。
(4) 比较k、m的气态氢化物的稳定性。(用化学式表示)
根据要求回答下列问题:
①CaBr2②H2O③NH4Cl④H2O2⑤Na2O2⑥Ca(OH)2⑦HClO
⑧I2⑨He⑩ Al____
(1)只含有离子键的是(用序号回答)_____
(2) 含有共价键的离子化合物是(用序号回答)_________
(3)含有共价键的共价化合物是(用序号回答)______________
(4)常温时为固体,当其熔化时,不破坏化学键的是(用序号回答)_______________
(5)熔融状态时和固态时,都能导电的有(用序号回答)____________
在11到18号元素中,除稀有气体元素外(填符号或化学式)
①原子半径最小的元素是,原子半径最大的元素是;
②非金属性最强的元素是,金属性最强的元素是;
③最高价氧化物对应水化物碱性最强的是,它对应的氧化物的化学式;
④最高价氧化物对应水化物酸性最强的是,它对应的氢化物的化学式;
⑤气态氢化物中最稳定的是,最不稳定的是;
⑥氧化物中呈两性的是,③中氧化物和④中氢化物反应的化学方程式。
如图所示,当关闭阀门K时,向甲中充入1.5 mol A、3.5 mol B,向乙中充入3 mol A、7 mol B,起始时,甲、乙体积均为V L。在相同温度和有催化剂存在的条件下,两容器中各自发生下列反应:3A(g)+ 2B(g) C(g)
C(g) +2D(g);ΔH<0达到平衡(Ⅰ)时,V(乙)="0.86V" L。请回答:
+2D(g);ΔH<0达到平衡(Ⅰ)时,V(乙)="0.86V" L。请回答: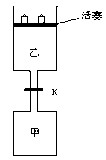
(1)乙中B的转化率为;
(2)甲中D和乙中C的物质的量比较:(填“相等”、“前者大”、“后者大”);
(3)打开K,过一段时间重新达平衡(Ⅱ)时,乙的体积为(用含V的代数式表示,连通管中气体体积忽略不计)。