NA为阿伏加德罗常数,下列叙述正确的是( )
| A.1.0L1.0mo1·L-1的NaNO3水溶液中含有的氧原子数为3NA |
| B.0.1molCu与足量的浓硫酸反应生成SO2的体积为2.24L |
| C.25℃时pH=13的Ba(OH)2溶液中含有OH一的数目为0.1NA |
| D.反应Cl2+2NaOH=NaCl+NaClO+H2O中,每消耗1molCl2转移电子数为 NA |
分类方法在化学学科的发展中起到重要的作用。下列分类标准合理的是( )
| A.根据纯净物中的元素组成,将纯净物分为单质和化合物 |
| B.根据溶液导电能力强弱,将电解质分为强电解质、弱电解质 |
| C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
| D.根据反应中的能量变化,将化学反应分为“化合、分解、复分解、置换”四类 |
下列说法不正确的是( )
| A.1 mol氧气的质量为32 g |
| B.标准状况下,0.5 molNO和0.5 mol O2的混合后体积约为22.4 L |
| C.CO2的摩尔质量为44 g/mol |
| D.1 L 2 mol/L的BaCl2溶液中含Cl-的个数为2.408×1024 |
下列关于“物质的量”、“摩尔”和“摩尔质量”的叙述中正确的是()
| A.物质的摩尔质量等于其相对分子(原子)质量 |
| B.“物质的量”是国际单位制中的一个基本单位 |
| C.0.012 kg12C中所含的碳原子数为NA |
| D.1mol任何物质都含有约6.02×1023个原子 |
下列说法正确的是( )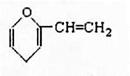
| A.纤维素属于髙分子化合物,与淀粉互为同分异构体,水解后均生成葡萄糖 |
| B.2,3一二甲基丁烷的H一NMR上有5个峰 |
| C.含5个碳原子的有机物,每个分子中最多可形成4个C一C单键 |
| D.某有机物结构如右图所示,该有机物属于芳香族化合物的同分 |
异构体有5种,其中遇FeCl3能显色的有3种
下列关于各实验装置的叙述中不正确的是( ) 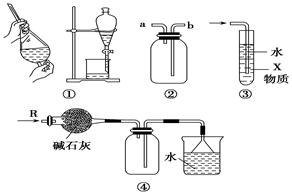
| A.装置①可用于分离C2H5OH和H2O的混合物 |
| B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体 |
| C.装置③中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸 |
| D.装置④可用于干燥、收集NH3,并吸收多余的NH3 |