已知25 ℃、101 kPa下,下列反应
C(石墨) + O2(g) === CO2(g) ,燃烧1 mol C(石墨)放热393.51 kJ。
C(金刚石) + O2(g) === CO2(g),燃烧1 mol C(金刚石)放热395.41 kJ。可以得出的结论是
| A.金刚石比石墨稳定 | B.1 mol石墨所具有的能量比1 mol金刚石低 |
| C.金刚石转变成石墨是物理变化 | D.石墨和金刚石都是碳的同位素 |
下列物质能导电且属于电解质的是()
| A.熔融的烧碱 | B.稀硫酸 | C.石墨 | D.NaCl溶液 |
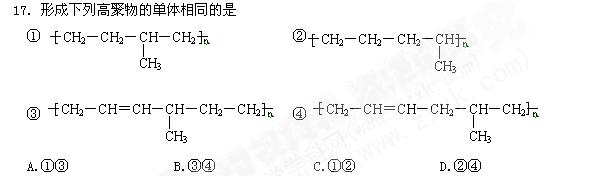
下列说法不正确的是
| A.互为同系物的有机物,它们的分子结构必然相似 |
| B.互为同分异构体的有机物,它们的分子式必然相同 |
| C.凡相对分子质量相等、各元素的质量分数相等,而结构不同的有机物一定互为同分异 构体 |
D.凡分子组成相差一个或几个原子团的物质一 定是同系物 定是同系物 |
下列实验能获得成功的是
| A.验证某RX是碘代烷,把RX与烧碱水溶液混合加热后,将溶液冷却后再加入硝酸银溶液 |
| B.除去苯中的少量苯酚:加入浓溴水振荡、静置后过滤,除去三溴苯酚沉淀 |
C.除去硝基苯中的硝酸:加入氢氧化钠溶液,振荡静置后 分液 分液 |
| D.1mol/L CuSO4溶液2mL和0.5mol/L NaOH溶液4mL混合后加入40%的乙醛溶液0.5mL,加热煮沸观察沉淀的颜色 |
分子式为C5H12O的某醇与溴化钠、硫酸混合加热得卤代烃,该卤代烃与强碱醇溶液共热后,不发生消去反应,该醇可能是:
| A.1-戊醇 | B.3-戊醇 | C.2,2-二甲基-1-丙醇 | D.2-甲基-2-丁醇 |