下列反应中,可用离子方程式CO32- + 2H+ =" CO2↑" + H2O表示的是( )
| A.CaCO3和足量盐酸反应 |
| B.Na2CO3溶液和足量醋酸(CH3COOH)反应 |
| C.Na2CO3溶液和足量稀硝酸反应 |
| D.NaHCO3溶液和足量稀硫酸反应 |
下面关于SiO2晶体网状结构的叙述正确的是( )
| A.存在四面体结构单元,O处于中心,Si处于4个顶角 |
| B.最小的环上,有3个Si原子和3个O原子 |
| C.最小的环上,Si和O原子数之比为1:2 |
| D.最小的环上,有6个Si原子和6个O原子 |
向盛有氯化钠溶液的试管中滴入少量硝酸银溶液,生成白色的氯化银沉淀,继续向试管里加入氨水,沉淀溶解,生成无色的配离子[Ag(NH3)2]+,下列说法正确的是()
| A.溶液中Cl-和Ag+的物质的量反应前后不变 |
| B.配位键的强度都很大,因而配合物都很稳定 |
| C.配位键可用带箭头的键线表示,是一种特殊的共价键 |
| D.在[Ag(NH3)2]+离子中,Ag+ 给出孤对电子,NH3提供空轨道 |
有下列符号:35Cl和37Cl、O2和O3、1H216O和2H218O。下列有关说法正确的是()
| A.35Cl和37Cl互称为同素异形体 | B.O2和O3是氧元素的两种同位素 |
| C.35和37表示的是质量数 | D.1H216O和2H218O表示同一种水分子 |
2008奥运吉祥物“福娃”,深受广大运动员的喜爱。其外面材料为纯羊毛,内充聚酯纤维,该聚酯纤维的结构简式如下图,下列说法中不正确的是()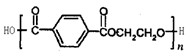
| A.羊毛与聚酯纤维的化学成分不相同 |
| B.该聚酯纤维单体为对苯二甲酸和乙二醇 |
| C.由单体合成聚酯纤维的反应属加聚反应 |
| D.聚酯纤维和羊毛在一定条件下均能水解 |
下列说法正确的是( )
| A.形成离子键的阴阳离子间只存在静电吸引力 |
| B.HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱 |
| C.第三周期非金属元素含氧酸的酸性从左到右依次增强 |
| D.元素周期律是元素原子核外电子排布周期性变化的结果 |