下列关于Cl2性质的说法正确的是
| A.密度比空气小 | B.是无色无味的气体 |
| C.能使干燥的有色布条褪色 | D.可与NaOH溶液反应 |
下列有关物质的性质与应用相对应的是()
| A.氢氟酸具有弱酸性,可用于雕刻玻璃 |
| B.Na2O2具有强氧化性,可用作自来水的消毒剂 |
| C.氯化铁溶液能氧化铜单质,可用于制作印刷电路板 |
| D.SO2具有漂白性,可使酸性高锰酸钾溶液褪色 |
下列有关实验装置进行的相应实验,能达到实验目的的是()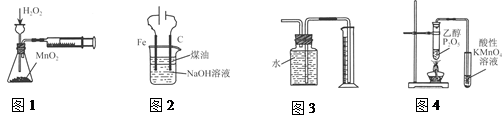
| A.图1定量测定H2O2的分解速率 |
| B.图2装置制备Fe(OH)2并能较长时间观察其颜色 |
| C.图3装置测量Cu与浓硝酸反应产生气体的体积 |
| D.图4证明CH3CH2OH发生消去反应生成了乙烯 |
常温下,下列各组离子在指定溶液中一定能大量共存的是()
| A.1.0 mol·L-1的CaCl2溶液:Na+、K+、Cl-、CO32- |
| B.1.0 mol·L-1的HNO3溶液:K+、[Ag(NH3)2]+、Cl-、SO42- |
| C.1.0 mol·L-1的KI溶液:Na+、Fe3+、Cl-、SO42- |
| D.澄清透明的溶液:Cu2+、SO42-、Mg2+、Cl- |
在碘酸钠(NaIO3)的碱性溶液中通入Cl2,可以得到高碘酸钠(Na2H3IO6).下列有关该反应的说法正确的是()
| A.Cl2作还原剂 |
| B.碱性条件下,NaIO3的氧化性强于Na2H3IO6 |
| C.每生成1 mol Na2H3IO6,转移2 mol电子 |
| D.氧化产物与还原产物的物质的量之比为2:1 |
下列化学用语正确的是()
| A.乙烯的比例模型: |
| B.HClO的结构式:HClO |
C.H2O2的电子式: |
| D.乙醇的分子式:CH3CH2OH |