某科研人员设计出将硫酸渣(主要成分Fe2O3,含有少量的SiO2等杂质)再利用的流程。流程中的滤液经过多次循环后用来后续制备氧化铁粉末。


(1)为了加快反应①的反应速率,可采用的措施是 。(写出一点即可)
(2)“还原”是将Fe3+转化为Fe2+。在温度T1 、T2(T1 >T2)下进行该反应,通过检测相同时间内溶液的pH,绘制pH随时间的变化曲线如右图所示。得出结论:该反应的温度不宜过高。
①通入SO2气体“还原”时, 试解释pH下降的原因是 。
②相同时间内,T1温度下溶液的pH更高的原因是 。
(3)该流程中循环使用的物质是 。
(4)为测定反应①后溶液中Fe3+的浓度以控制加入SO2的量。实验步骤为:准确量取20.00ml的反应后溶液,稀释成100mL溶液,取10.00 mL溶液,加入足量的KI晶体和2~3滴淀粉溶液,用0.50mol/L的Na2S2O3溶液与碘反应,当反应恰好完全进行时,共消耗Na2S2O3溶液20.00 mL。有关反应方程式如下:2Fe3++2I-=2Fe2++I2; 2Na2S2O3 + I2= Na2S4O6 + 2NaI
试计算原溶液中Fe3+的物质的量浓度(写出计算过程)。
将2.4mol某金属投入1.8L 2mol/L的酸中,恰好完全反应,并得到7.2gH2,则某金属的化合价为,该酸为元酸。
已知19g某二价金属的氯化物RCl2中含有0.4mol的Cl-离子,则R的相对原子质量为。
同温同压下,质量相同的五种气体: ① CO2 ② H2 ③ O2 ④ CH4 ⑤ SO2
所占的体积由大到小的顺序是(填序号,下同)_________________;
所含原子数由多到少的顺序是__________________________;
密度由大到小的顺序是_________________________________。
质量比为14 :15的N2和NO混合,则混合气体中N2和NO的物质的量之比为______,氮原子和氧原子的个数比为________,该混合气体的平均摩尔质量为___________。
苯酚是重要的化工原料,通过下列流程可合成阿司匹林、香料和一些高分子化合物。已知: 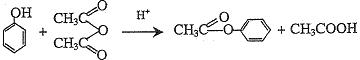
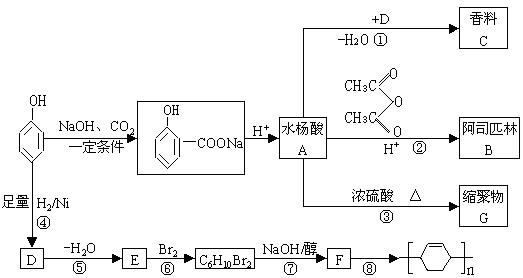
(1)写出C的结构简式。
(2)写出反应②的化学方程式。
(3)写出G的结构简式。
(4)写出反应⑧的化学方程式。
(5)写出反应类型:④⑦。
(6)下列可检验阿司匹林样品中混有水杨酸的试剂是。
(a)三氯化铁溶液 (b)碳酸氢钠溶液 (c)石蕊试液