W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如右图。已知W的一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期元素中最强,下列说法正确的是
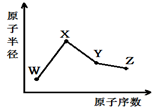
| A.最高化合价X>Y>Z>W |
| B.气态氢化物的稳定性Z>Y>W |
| C.Y的氧化物与X、Z的最高价氧化物对应的水化物均能反应 |
| D.由X、Z、W三种元素形成的化合物一定既含离子键又含共价键 |
一种具有除草功效的有机物的结构简式如图所示。下列有关该化合物的说法正确的是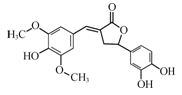
| A.分子中含有2个手性碳原子 |
| B.能发生氧化、取代、加成反应 |
| C.1 mol该化合物与足量浓溴水反应,最多消耗3 mol Br2 |
| D.1 mol该化合物与足量NaOH溶液反应,最多消耗4 mol NaOH |
某种熔融碳酸盐燃料电池以Li2CO3、K2CO3为电解质、以CH4为燃料时,该电池工作原理如图,下列说法正确的是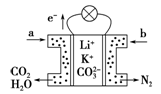
| A.a为CH4,b为CO2 |
| B.CO32-向负极移动 |
| C.此电池在常温时也能工作 |
| D.正极电极反应式为O2+2H2O+4e-="==" 4OH- |
下列各化合物中,能发生酯化、加成、消去三种反应的是
| A.CH3—CH==CH—CHO |
B. |
| C.HOCH2—CH2—CH==CH—CHO |
D. |
下列说法正确的是
| A.用酸性KMnO4溶液能鉴别CH3CH==CHCH2OH和CH3CH2CH2CHO |
| B.用图所示方法可保护钢闸门不被腐蚀 |
| C.根据核磁共振氢谱不能鉴别1溴丙烷和2溴丙烷 |
| D.食用花生油和鸡蛋清都能发生水解反应 |
下列实验操作或装置正确的是
| A.利用图1所示装置吸收制取少量二氧化硫产生的尾气 |
| B.利用图2所示装置制取乙烯 |
| C.利用图3所示装置证明H2CO3酸性强于苯酚 |
| D.利用图4所示装置制备乙酸乙酯 |