[化学—选修2化学与技术]《科学》曾评出10大科技突破,其中“火星上‘找’到水的影子”名列第一。水是一种重要的自然资源,是人类赖以生存不可缺少的物质。水质优劣直接影响人体健康。海洋是化学资源宝库,海洋资源的综合利用具有广阔的前景。人类把海水淡化,就可以得到大量的饮用水,常规蒸馏法,技术和工艺比较完备,但也存在较大缺陷,大量推广离子交换法和电渗析法。
(1)天然水在净化处理过程中加入明矾做混凝剂,其净水作用的原理是_________(用离子方程式表示)
(2)家庭用水可以用肥皂水检验其硬度,因为 。家用净水器中装有活性炭和阳离子交换树脂(NaR),用过的阳离子交换树脂放入 中可再生。
(3)电渗析法淡化海水的示意图如图所示,其中阴(阳)离子交换膜仅允许阴(阳)离子通过。

阳极的主要电极反应式是________。在阴极附近加入无色酚酞,看到的现象是___________________________。淡水的出口为________(填“a”“b”或“c”)。
(4)利用海水制得的食盐,制取纯碱的简要过程如下:向饱和食盐水中先通入气体A,后通入气体B,充分反应后过滤得到晶体C和滤液D,将晶体C灼烧即可制得纯碱。
①滤出晶体C后,从滤液D中提取氯化铵有两种方法:
方法一、通入氨,冷却、加食盐,过滤;
方法二、不通氨,冷却、加食盐,过滤。
对两种方法的评价正确的是(选填编号)_____________。
a.方法一析出的氯化铵纯度更高 b.方法二析出的氯化铵纯度更高
c.方法一的滤液可直接循环使用 d.方法二的滤液可直接循环使用
②提取的NH4Cl中含有少量Fe2+、SO42―。将产品溶解,加入H2O2,加热至沸,再加入BaCl2溶液,过滤,蒸发结晶,得到工业氯化铵。加热至沸的目的是___________。滤渣的主要成分是_______________、____________________。
合理选择饮食是保证身心健康的重要方面。请回答。
(1)高温消毒灭菌时,蛋白质发生________,失去生理活性。
(2)粮食中的糖类在人体内转化为_____________而被吸收,为人体提供营养。
(3)既能为人体提供热量, 又能提供必需脂肪酸的物质是____________。
电解原理在化学工业中有广泛应用。下图表示一个电解池,装有电解液c;M、N是两块电极板,通过导线与直流电源相连。
请回答以下问题:
(1)若M、N都是惰性电极,c是饱和NaCl溶液,实验开始时,同时在U形管两边各滴入几滴酚酞试液,则:极(填“M”或“N”)附近先呈红色;电解饱和NaCl溶液的总反应方程式:。
(2)若要进行粗铜(含Al、Zn、Ag、Pt、Au等杂质)的电解精炼,电解液c选用CuSO4溶液,则:
①N电极反应式是。(说明:杂质发生的电极反应不必写出)
②下列说法正确的是________。
| A.电能全部转化为化学能 |
| B.在电解精炼中,电解液中有Al3+、Zn2+产生 |
| C.溶液中Cu2+向阳极移动 |
| D.阳极泥中可回收Ag、Pt、Au等金属 |
(3)用惰性电极电解CuSO4溶液。若阴极析出Cu的质量为16g,则阳极上产生的气体在标准状况下的体积为 L 。
在一定体积的密闭容器中,进行化学反应2CO2 (g)+N2 (g) 2CO (g)+2NO (g),其化学平衡常数K和温度t的关系如下表:
2CO (g)+2NO (g),其化学平衡常数K和温度t的关系如下表:
| t / ℃ |
700 |
800 |
830 |
1000 |
1200 |
| K |
0.6 |
0.9 |
1.0 |
1.7 |
2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=____________________________________。
(2)正反应为________反应(填“吸热”或“放热”)。
(3)能判断该反应是否达到化学平衡状态的依据是________。
A.容器中压强不变B.混合气体中c (CO)不变
C.v正(N2)=v逆(NO)D.c(CO2)="c" (CO)
可逆反应:aA(g)+ bB(g)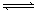 cC(g)+ dD(g);根据图回答:
cC(g)+ dD(g);根据图回答: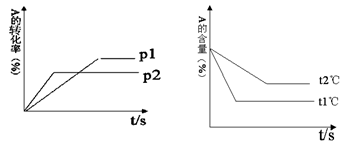
(1)压强P1比P2 (填大或小);
(2)(a+b)比(c +d)(填大或小);
(3)温度t1℃比t2℃(填高或低);
(4)正反应为(填吸热或放热)反应。
(2分)1.2g碳与适量的水蒸气反应生成CO和H2,需吸收13.128 kJ热量,此反应的热化学方程式是。