[化学—选修3物质结构与性质] T、W、X、Y、Z是元素周期表前四周期中的常见元素,原子序数依次增大,相关信息如下表。
| 元素 |
相关信息 |
| T |
T元素可形成自然界硬度最大的单质 |
| W |
W与T同周期,核外有一个未成对电子 |
| X |
X原子的第一电离能至第四电离能分别是:I1=578kJ/mol,I2=1817kJ/mol,I3=2745kJ/molkJ/mol,I4=11575kJ/mol |
| Y |
常温常压下,Y单质是固体,其氧化物是形成酸雨的主要物质 |
| Z |
Z的一种同位素的质量数为63,中子数为34 |
(1)TY2是一种常用的溶剂,是 (填极性分子或非极性分子),分子中存在 个σ 键。W的最简单氢化物容易液化,理由是 。
(2)在25℃、101kpa下,已知13.5g的X固体单质在O2气体中完全燃烧后恢复至原状态,放热419kJ,该反应的热化学方程式为 。
(3)基态Y原子中,电子占据的最高能层符号 ,该能层具有的原子轨道数为 、电子数为 。Y、氧、W元素的第一电离能由大到小顺序为 (用元素符号作答)。
(4)已知Z的晶胞结构如图所示,又知Z的密度为9.00 g/cm3,则晶胞边长为 ;ZYO4常作电镀液,其中YO42-的空间构型是 ,其中Y原子的杂化轨道类型是 。元素Z与人体分泌物中的盐酸以及空气反应可生成超氧酸:Z+HCl+O2=ZCl+HO2,HO2 (超氧酸)不仅是一种弱酸而且也是一种自由基,具有极高的活性。下列说法或表示正确的是

A.O2是氧化剂
B.HO2 是氧化产物
C.HO2在碱中能稳定存在
D.1 mol Z参加反应有1 mol电子发生转移
某实验小组利用饱和食盐水、导线、直流电源(用“ ” 或“
” 或“ ”表示)、烧杯、灵
”表示)、烧杯、灵
敏电流计(用“ ”表示)和两个电极棒(分别是M、N)进行电化学实验探究。
”表示)和两个电极棒(分别是M、N)进行电化学实验探究。
甲同学安装好仪器,接好直流电源通电几分钟,发现M处溶液逐渐变浅绿色,过一段时间,溶液变得浑浊且逐渐出现红棕色。
乙同学所用的仪器和甲同学的看上去相同,但接好直流电源通电几秒钟,却闻到一股刺鼻的气味,马上停止通电。
丙同学安装好仪器,线路闭合几秒钟后,却没有发现明显现象产生,他又很快接入灵敏电流计,发现电流计的指针发生了偏转。
请根据上述同学的实验现 象回答以下问题:
象回答以下问题:
(1)M电极棒材料是(写化学式),N电极棒材料是(写化学式)。
(2)在下列虚框内完成对应三个同学的装置图: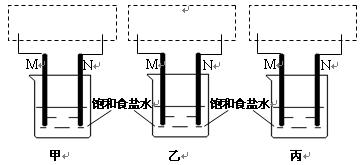
(3)按要求写出三个同学实验过程中涉及的反应方程式:
甲同学N电极方程式
乙同学总反应的离子方程式
丙同学N电极方程式
(4)用化学方程式解释甲同学实验时观察到M处溶液出现浑浊后转为红棕色现象的原因: 。
。
(5)丙同学为了保护M电极不被腐蚀,他可以将N电极棒更换为(写化学式)。为验证该防护方法有效,他又做下列对比实验:接通电路2分钟后,分别在M电极区滴入2滴黄色K3[Fe(CN)6]溶液,发现没有更换N电极棒的烧杯中的现象是。
下图所示装置中,甲、乙、丙三个烧杯依次分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液和100g 10.00%的K2SO4溶液,电极均为石墨电极。接通电源,经过一段时间后,测得丙中K2SO4浓度为10.47%,乙中c电极质量增加。据此回答问题: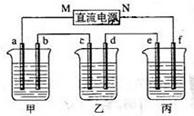
(1)电源的N端为极;
(2)写出电解前后各溶液的pH变化情况(增大、减小或不变 ):
):
甲溶液;乙溶液;丙溶液;
(3)电极b上生成的气体在标准状态下的体积是;
电极c的质量变化是g。
(19分)有机物W(C3H6O3)能与NaHCO3反应,分子中含有四种活动性不同的氢原子,个数比为3:1:1:l。
(1)W的结构简式是。
(2)W的工业合成路线如下图所示:
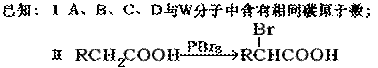
①写出A的结构简式是。
②B与新制Cu(OH)2悬浊液反应的化学方程式是。
③D在NaOH水溶液中反应的化学方程式是
____________________________________________________________。
(3)工业也可以用下图所示合成路线生产W: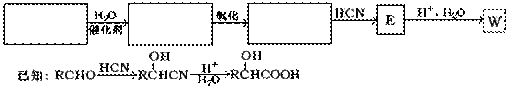
请在合成路线框图中填入相应有机物的结构筒式。
(4)①W在一定条件下,反应生成丙交酯(C6H8O4),该反应的化学方程式是(有机物写结构简式)。
②丙交酯在一定条件下聚合生成聚丙交酯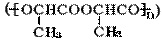 ,聚丙交酯经抽丝可制成手术缝合线,在人体内可自动缓慢降解为W。聚丙交酯在体内降解的化学方程式是。
,聚丙交酯经抽丝可制成手术缝合线,在人体内可自动缓慢降解为W。聚丙交酯在体内降解的化学方程式是。
(1)下列事实中,能证明亚硫酸的酸性强于氢硫酸的是 (填字母)。
a.亚硫酸受热时易分解
b.相同条件下,等浓度的亚硫酸溶液导电能力强于氢硫酸
c.亚硫酸溶液可使品红溶液褪色,而氢硫酸不能
d.常温下,浓度均为0.1mol/L的H 2SO 3溶液和H 2S溶液的pH分别是2.1和4.5
(2)工业上除去高压锅用水中溶解的氧气常用的试剂有Na 2SO 3和N 2H 4(肼)。
①已知16g液态的肼与氧气反应得到氮气和液态水时,放热354.87kJ,该反应的热化学方程式是 。
②除去等质量的O 2,所耗Na 2SO 3和N 2H 4的质量比是 (填最简整数比)。
(3)向Na 2SO 3和Na 2S的混合溶液中加入稀盐酸,溶液中会产生大量淡黄色沉淀。则该反应中氧化剂和还原剂的物质的量之比是 。
(4)已知Na 2SO 3在高温下发生分解,得到两种产物。某同学称取25.2g纯净的Na 2SO 3·7H 2O晶体在高温下隔绝空气加热至恒重,冷却后称得固体为12.6g,将其完全溶于水配成1L溶液,并测溶液的pH。
①Na 2SO 3高温分解的化学方程式是 。
②测得溶液的pH大于0.025mol/LNa 2SO 3溶液的pH,试解释原因(结合离子方程式说明) 。
阅读下面的信息,推断元素及有关物质,按要求回答物质:
信息①:X、Y、Z、W是常见的短周期元素,其原子序数依次增大,且原子核外最外层电子数均不少于2。
(1)根据信息①,X一定不是(填序号)
| A.氢 | B.碳 | C.氧 | D.硫 |
信息②:上述四种元素的单质均能在足量的氧气中燃烧,生成的四种氧化物中,有两种能溶于稀硫酸,三种能溶于浓氢氧化钠溶液,氧化物的相对分子质量都大于26。
(2)这四种元素中是否有一种是铝元素?为什么?
;。
信息③:向上述四种元素单质组成的混合物中加入足量盐酸溶液,固体部分溶解,过滤,向滤液中加入过量的烧碱溶液,最终溶液中析出白色沉淀。
(3)白色沉淀物的化学式为。
信息④:向上述四种元素单质组成的混合物中加入足量烧碱溶液,固体部分溶解,过滤,向滤液中加入过量的盐酸溶液,最终溶液中析出白色沉淀。
(4)生成白色沉淀物的离子方程式为 。
。
信息⑤:上述四种元素中,X与W同主族。
(5)X与浓硫酸反应的化学方程式为。