如图所示的两个实验装置中,溶液的体积均为200 mL,开始时电解质溶液的浓度均为0.1 mol·L-1,工作一段时间后,测得导线中均通过0.02 mol电子,若不考虑溶液体积的变化,则下列叙述中不正确的是( )
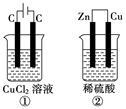
| A.电极上产生气体的体积:①=②(相同条件) |
| B.①和②中溶液的pH都减小 |
| C.电极上析出物质的质量:①>② |
| D.发生氧化反应的电极为:①中阳极,②中负极 |
下列各组物质能用分液漏斗进行分离的是
| A.汽油和四氯化碳 | B.碘与四氯化碳 |
| C.酒精与汽油 | D.水与苯 |
下列仪器可加热的是
| A.圆底烧瓶 | B.分液漏斗 | C.容量瓶 | D.细口瓶 |
下列对化学反应的认识正确的是 ( )
| A.氧化还原反应都是放热反应 |
| B.化学反应过程中一定有化学键的断裂和形成 |
| C.伴随能量变化的物质变化都是化学变化 |
| D.化学反应过程中,分子的种类和数目一定发生改变 |
澳大利亚研究人员最近开发出被称为第五形态的固体碳,这种新的碳结构称作“纳米泡沫碳”,它外形类似海绵,密度极小,并具有磁性。纳米泡沫碳与金刚石的关系是 ( )
| A.同种物质 | B.不同密度的核素 | C.同位素 | D.同素异形体 |
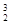 He可以作为核聚变材料。下列关于
He可以作为核聚变材料。下列关于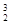 He的叙述中,正确的是 ( )
He的叙述中,正确的是 ( )
| A.质子数为2 | B.电子数为3 | C.中子数为2 | D.质量数为2 |