下列化学方程式或离子方程式正确的是( )
| A.FeS加入稀硫酸溶液中:FeS+2H+===Fe2++H2S↑ |
| B.Ca(HCO3)2溶液与足量NaOH溶液反应:Ca2++HCO3-+OH-===CaCO3↓+H2O |
| C.铜片跟浓硝酸反应:3Cu+2NO3-+8H+===3Cu2++2NO↑+4H2O |
| D.酸性KMnO4溶液中滴加H2O2:2MnO4-+H2O2+6H+===2Mn2++3O2↑+4H2O |
某小组为研究电化学原理,设计如图2装置。下列叙述不正确的是()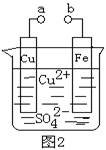
| A.a和b不连接时,铁片上会有金属铜析出 |
| B.a和b用导线连接时,铜片上发生的反应为:Cu2++2e-= Cu |
| C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色 |
| D.a和b分别连接直流电源正、负极,Cu2+向铜电极移动 |
研究人员研制出一种锂水电池,可作为鱼雷和潜艇的储备电源。该电池以金属锂和钢板为电极材料,以LiOH为电解质,使用时加入水即可放电。关于该电池的下列说法不正确的是()
| A.水既是氧化剂又是溶剂 |
| B.放电时正极上有氢气生成 |
| C.放电时OH-向正极移动 |
| D.总反应为:2Li+2H2O="==" 2LiOH+H2↑ |
某温度下,反应SO2(g)+  O2(g)
O2(g)  SO3 (g) 的平衡常数K1=50,在同一温度下,反应2SO3(g)
SO3 (g) 的平衡常数K1=50,在同一温度下,反应2SO3(g)  2SO2(g) + O2(g)的平衡常数K2的值为()
2SO2(g) + O2(g)的平衡常数K2的值为()
| A.2500 | B.100 | C.4×10-4 | D.2×10-2 |
铁镍蓄电池又称爱迪生电池,放电时的总反应为:
Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2
下列有关该电池的说法不正确的是()
| A.电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe |
| B.电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2 |
C.电池充电过程中,阴极附近溶液 的pH降低 的pH降低 |
| D.电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O |
对可逆反应4NH3(g)+5O2(g) 4NO(g)+6H2O(g),下列叙述正确的是()
4NO(g)+6H2O(g),下列叙述正确的是()
| A.达到化学平衡时,4v正(O2)=5v逆(NO) |
| B.若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态 |
| C.达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大 |
D.化学反应速率 关系是:v(正)>v(逆) 关系是:v(正)>v(逆) |