下列检验某溶液中是否含有SO42- 的方法中正确的是
| A.向该溶液中加入酸化的Ba(NO3)2溶液出现白色沉淀,说明溶液中一定有SO42- |
| B.向该溶液中加入BaCl2溶液出现白色沉淀,说明该溶液中一定有SO42- |
| C.向该溶液中加入足量HCl,无现象,再加入BaCl2溶液出现白色沉淀,说明该溶液中一定有SO42- |
| D.向该溶液中加入BaCl2溶液,产生白色沉淀,再加入HCl沉淀不溶解,说明该溶液中一定有SO42- |
已知化学反应的热效应只与反应物的初始状态和生成物的最终状态有关,如图(Ⅰ)所示:ΔH1=ΔH2+ΔH3;根据上述原理和图(Ⅱ)所示,判断各对应的反应热关系中不正确的是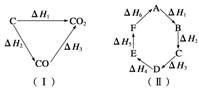
| A.A―→F ΔH=-ΔH6 |
| B.A―→D ΔH=ΔH1+ΔH2+ΔH3 |
| C.ΔH1+ΔH2+ΔH3+ΔH4+ΔH5+ΔH6=0 |
| D.ΔH1+ΔH6=ΔH2+ΔH3+ΔH4+ΔH5 |
在密闭容器中充入4molX,在一定温度下4X(g) 3Y(g)+Z(g)达到平衡时,有30%的X发生分解,则平衡时混合气体总的物质的量是
3Y(g)+Z(g)达到平衡时,有30%的X发生分解,则平衡时混合气体总的物质的量是
| A.4mol | B.3.4mol | C.2.8mol | D.1.2mol |
合成氨反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如下图。下列说法正确的是
2NH3(g) ΔH=-92.4 kJ·mol-1,在反应过程中,正反应速率的变化如下图。下列说法正确的是
| A.t1时升高了温度 | B.t2时使用了催化剂 |
| C.t3时增大了压强 | D.t4时降低了温度 |
在一定温度下,向密闭容器中充入1.0molN2和3.0molH2,反应达到平衡时测得NH3的物质的量为0.6mol。若在该容器中开始时充入2.0 molN2和6.0molH2,则平衡时NH3的物质的量为
| A.若为定容容器,n(NH3)=1.2mol | B.若为定压容器,n(NH3) >1.2mol |
| C.若为定容容器,n(NH3)>1.2mol | D.若为定压容器,n(NH3)<1.2mol |
在一定温度下将各1mol CO和水蒸气放在密闭的容器中反应:CO(g)+H2O(g) CO2(g)+ H2(g)达到平衡后,测得CO2为0.6mol,再通入4mol水蒸气,达到平衡后CO2的物质的量为
CO2(g)+ H2(g)达到平衡后,测得CO2为0.6mol,再通入4mol水蒸气,达到平衡后CO2的物质的量为
| A.等于0.6mo | B.等于1mol |
| C.大于0.6mol小于1mol | D.大于1mol |