A、B、C、D、E为短周期元素,在周期表中所处的位置如下图所示。A、C两种元素的原子核外电子数之和等于B原子的质子数,B原子核内质子数和中子数相等:
(1)写出三种元素名称A、B 、C。
(2)B元素位于元素周期表中第周期,族。
(3)比较B、D、E三种元素的最高价氧化物的水化物酸(碱)性最强的是(用化学式表示);E和Na 形成的化合物的电子式是。
对于反应:2SO2+O2 2SO3,当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)
2SO3,当其他条件不变时,只改变一个反应条件,将生成SO3的反应速率的变化填入空格里(填写“增大”“减小”“不变”)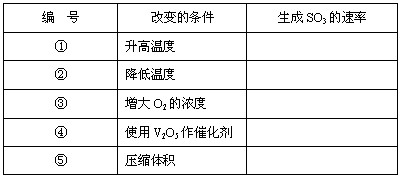
判断物质中化学键时应该注意一些问题,下列说法中正确的是
①存在离子键的化合物一定是离子化合物,离子化合物中一定存在离子键
②离子化合物可以只含非金属元素,也可以存在共价键,如NH4Cl
③共价化合物中只含有共价键,不含离子键
④非金属单质(稀有气体除外)中只含有共价键
⑤稀有气体由单原子组成,无化学键
⑥只含有共价键的化合物一定是共价化合物,只含有共价键的物质不一定是共价化合物,可能是单质;含有共价键的化合物不一定是共价化合物,可能是离子化合物,例如NaOH
画出下列短周期元素的原子结构示意图:
(1)质量数为23,中子数为12的原子
(2)最外层电子数是次外层电子数3倍的原子
发生化学反应时,破坏化学键需要能量,形成化学键需要能量。吸收能量用E1表示,释放能量用E2表示,当E1E2时,反应吸收能量;当E1E2时,反应释放能量