工业品MnCl2溶液中含有Cu2+、Pb2+等离子,加入过量难溶电解质MnS,可使Cu2+、Pb2+等离子形成沉淀,以制取纯净MnCl2。由此可推知MnS( )
| A.具有吸附性 | B.溶解度小于CuS、PbS |
| C.溶解度与CuS、PbS相同 | D.溶解度大于CuS、PbS |
下列能正确表示水解的离子方程式是
A.CH3COOH + H2O 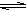 CH3COO- + H3O+ CH3COO- + H3O+ |
B.NH4+ + H2O 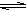 NH3·H2O + H+ NH3·H2O + H+ |
C.CO32- + 2H2O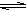 H2CO3 + 2OH- H2CO3 + 2OH- |
D.Br- + H2O 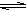 HBr + OH- HBr + OH- |
在蒸发皿中加热蒸干并灼烧下列物质的溶液,可以得到该物质的是
| A.硫酸镁 | B.碳酸氢钠 | C.氯化铝 | D.盐酸溶液 |
一定温度下,在氢氧化钙的悬浊液中,存在氢氧化钙固体与其电离出的离子间溶解结晶平衡:Ca(OH)2(s)  Ca2+(aq)+2OHˉ(aq)。向此种悬浊液中加入少量的氧化钙粉末,充分反应后恢复到原温度。下列叙述正确的是
Ca2+(aq)+2OHˉ(aq)。向此种悬浊液中加入少量的氧化钙粉末,充分反应后恢复到原温度。下列叙述正确的是
| A.溶液中钙离子数目减小 | B.溶液中钙离子浓度减少 |
| C.溶液中氢氧根离子浓度增大 | D.pH减小 |
在一定温度条件下,对于已达到平衡的反应:
FeCl3 +3KSCN 3KCl+Fe(SCN)3,在此溶液中作如下处理,平衡左移的是
3KCl+Fe(SCN)3,在此溶液中作如下处理,平衡左移的是
| A.加入少量氯化钾固体 | B.加入少量氯化铁固体 |
| C.减少Fe(SCN)3的浓度 | D.加水稀释 |
盖斯定律认为:不管化学过程是一步或分为数步完成,这个过程的热效应是相同的。
已知:H2O(g)= H2O(l)△H1 =-Q1 kJ·mol-1(Q1>0)
C2H5OH(g)= C2H5OH(l)△H2 =-Q2 kJ·mol-1(Q2>0)
C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) △H3 = -Q3 kJ·mol-1(Q3>0)若使23g液态乙醇完全燃烧,最后恢复到室温,则放出的热量为(kJ)
| A.Q1+ Q2+Q3 | B.0.5(Q1+Q2+Q3 ) |
| C.0.5 Q1-1.5 Q2+0.5Q3 | D.1.5 Q1-0.5 Q2+0.5Q3 |