下列说法不正确的是( )
| A.在25 ℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=2×10-9/(c-0.02) |
| B.0.1 mol·L-1醋酸溶液中:c2(H+)=c(H+)·c(CH3COO-)+KW |
C.常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH的关系如下图所示,当pH=4.5时,溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) |
| D.等体积等物质的量浓度的CH3COONa(aq)与NaCl(aq)中离子总数大小:N前>N后 |
某稀硫酸和稀硝酸的混合溶液200 mL,平均分成两份。向其中一份中逐渐加入铜粉,最多能溶解19.2 g(已知硝酸只被还原为NO气体)。向另一份中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示。下列分析或结果错误的是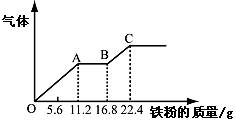
| A.原混合酸中NO3-物质的量为0.4 mol |
| B.原混合酸中H2SO4浓度为2.0 mol·L-1 |
| C.第二份溶液中最终溶质为FeSO4 |
D.OA段产生的是 NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 NO,AB段的反应为Fe+2Fe3+=3Fe2+,BC段产生氢气 |
120 mL含有0.20 mol碳酸钠的溶液和200 mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是
| A.2.0mol/L | B.0.15 mol/L | C.1.8 mol/L | D.0.24mol/L |
甲、乙、丙、丁4种物质分别含2种或3种元素,它们的分子中各含18个电子,甲是气态氢化物,在水中分步电离出两种阴离子,下列推断合理的是
| A.某钠盐溶液含甲电离出的阴离子,则该溶液显碱性,只能与酸反应 |
| B.乙与氧气的摩尔质量相同,则乙一定含有极性键和非极性键 |
| C.丁和甲中氢元素质量比相同,则丁中一定含有氧元素 |
| D.丙中含有第2周期ⅣA族的元素,则丙一定是甲烷的同系物 |
用水热法制备Fe3 O4纳米颗粒的总反应如下:
O4纳米颗粒的总反应如下:
3 Fe2++ 2S2O32-+O2+4OH-= Fe3O4 + S4O62-+2H2O。下列说法正确的是
| A.在反应中硫元素被氧化,铁元素被还原 |
| B.还原剂是Fe2+,氧化剂是S2O32-和O2 |
| C.每生成1mol Fe3O4,转移3mol电子 |
| D.当转移1mol电子时,消耗56g S2O32- |
将1 mol A(g)和2 mol B(g)置于2L某密闭容器中,在一定温度下发生反应: A(g)+B(g)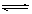 C(g)+D(g),并达到平衡。C的体积分数随时间变化如下图I中曲线b所示,反应过程中的能量变化如图II所示,下列说法不正确的是
C(g)+D(g),并达到平衡。C的体积分数随时间变化如下图I中曲线b所示,反应过程中的能量变化如图II所示,下列说法不正确的是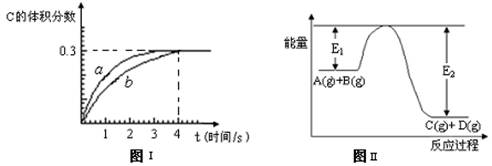
A.反应在第4秒钟达到化学平衡状态,0~4秒内,以A表示的化学反应速率是0.225mol·L-1·s-1
B.该温度下,反应的平衡常数数值约为7.36