下列化合物:①HCl、②NaOH、③CH3COOH、④NH3•H2O、⑤CH3COONa、⑥NH4Cl
(1)属于弱电解质的是 ,溶液呈碱性的有 (填序号).
(2)常温下0.01mol/L HCl溶液的pH= ;pH=11的CH3COONa溶液中由水电离产生的c(OH﹣)= .
(3)将等pH等体积的HCl和CH3COOH分别稀释m倍和n倍,稀释后两溶液的pH仍相等,则m n (填“大于、等于、小于”).
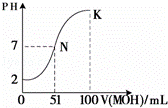
(4)常温下,向100mL 0.01mol•L﹣1HA溶液逐滴加入0.02mol•L﹣1MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).回答下列问题:
①N点对应的溶液中,c(M+) c(A﹣)(填“大于、等于、小于”).
②K点对应的溶液中,c(M+)+c(MOH)= mol•L﹣1.
肉桂酸甲酯是常用于调制具有草莓、葡萄、樱桃、香子兰等香味的食用香精。它的分子式为C10H10O2,且分子中只含有1个苯环,苯环上只有一个取代基。已知某一种肉桂酸甲酯的分子结构模型如下图所示(图中球与球之间连线表示单键或双键)。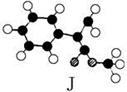
试回答下列问题。
肉桂酸甲酯的结构简式为。(2)分子中的官能团的名称为。
(3)在苯环上的一氯代物有种。
(4)写出该肉桂酸甲酯在氢氧化钠溶液中水解的化学方程式:_________________________。
H2可以催化还原NO以达到消除污染的目的:
(1)已知:①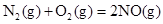
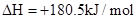
②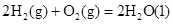
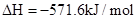
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式为:________________。
(2)一定条件下,在体积为2 L的容器中通入1 mol H2和l mol NO气体生成N2(g)和H2O(l),该反应达平衡时,容器内的压强是反应起始时的40%。保持其它条件不变,只往容器中再通入1 mol H2,计算反应再达新平衡时,化学平衡常数为__________。
元素Cu的一种氯化物晶体的晶胞结构如图所示,计算推出该氯化物的化学式是______,它可与浓盐酸发生非氧化还原反应,生成配合物H2CuCl3,反应的化学方程式为____________________。
按下图装置进行实验,回答下列问题(C、C1、C2均为石墨电极)。
(1)铁电极为__________极,电极反应式为__________;
(2)石墨棒C1为__________极,石墨棒C2附近的实验现象为____________________。
(3)当C2极产生2.24 L气体(标准状态)时,A中CuSO4溶液的质量改变了__________g。
A、B、C、D分别代表四种不同的短周期元素。A元素的原子最外层电子排布为ns1,B元素的原子价电子排布为ns2np2,C元素原子的最外层电子数是其电子层数的3倍,D元素原子的M电子层的p能级中有3个电子。
(1)C原子的基态电子排布式为__________;若A元素的原子最外层电子排布为1s1,则按原子轨道的重叠方式分类,A与C形成的最简单化合物中的共价键属于__________键。
(2)当n=2时,元素A在周期表中的位置是__________,B与C形成的化合物的VSEPR模型名称为__________形。
(3)当n=3时,B与C形成的晶体类型是__________,此时A、B、C、D四种元素的第一电离能由大到小的顺序是__________(用元素符号表示)。