在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:
(1)当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是________。
(2)同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是________。
(3)若三者c(H+)相同时,物质的量浓度由大到小的顺序是______________________________。
(4)将c(H+)相同的这三种酸均加水稀释至原来的100倍后,c(H+)由大到小的顺序是________。
(5)在不同温度下的水溶液中c(H+)=10x mol/L,c(OH-)=10y mol/L,x与y的关系如下图所示。请回答下列问题: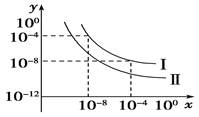
①曲线Ⅰ代表的温度下,水的离子积为_____,曲线Ⅰ所代表的温度_____(填“高于”“低于”或“等于”)曲线Ⅱ所代表的温度。你判断的依据是_________________________。
②曲线Ⅰ所代表的温度下,0.01 mol/L的NaOH溶液的pH为________。
阳极反应式:2CO+2CO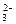
 4CO2+4e-
4CO2+4e-
阴极反应式: ,总电池反应式: 。

(1)当以I="0.21" A的电流电解60 min后,测得铜片A的质量增加了0.25 g,则图装置中的X端应与直流电的__________极相连,它是电解池的__________极。
(2)电解后铜片B的质量__________。(答“增加”“减少”或“不变”)
(3)列式计算实验测得的阿伏加德罗常数NA。(已知电子电量e=1.60×10-19C)
二甲苯苯环上的一溴代物有六种同分异构体,这些一溴代物与生成它的对应二甲苯的熔点分别是:
由上述数据可以推断,熔点为234℃的一溴代二甲苯结构简式是①,熔点为-54℃的二甲苯名称是②。
A、B两种有机化合物,分子式都是C9H11O2N。化合物A是天然蛋白质的水解产物,光谱测定显示:分子结构中不存在甲基(—CH3),化合物A的结构式是_____。化合物B是某分子式为C9H12的芳香烃—硝化后的唯一产物(硝基连在芳环上)。化合物B的结构简式是______。
化合物A(C8H8O3)为无色液态,难溶于水,有特殊香味,从A出发,可发生图示的一系列反应,图中的化合物A硝化时可生成四种一硝基取代物,化合物H的分子式为C6H6O,G能发生银镜反应。
(1)下列化合物可能的结构简式:A____,E____,K____。
(2)反应类型(Ⅰ)____(Ⅱ)____(Ⅲ)____。
(3)反应方程式:H→K:_________C→E:_________
C+F→G:_________。