某学生用0.1 mol·L-1的KOH标准溶液滴定未知浓度的盐酸,其操作分解为如下几步:
| A.移取20 mL待测盐酸注入洁净的锥形瓶,并加入2~3滴酚酞 |
| B.用标准溶液润洗滴定管2~3次 |
| C.把盛有标准溶液的碱式滴定管固定好,调节滴定管尖嘴使之充满溶液 |
| D.取标准KOH溶液注入碱式滴定管至“0”刻度以上1~2 cm |
E.调节液面至“0”或“0”以下某一刻度,记下读数
F.把锥形瓶放在滴定管的下面,用标准KOH溶液滴定至终点并记下滴定管液面的刻度
就此实验完成填空:
(1)正确操作步骤的顺序是(用序号字母填写)__________________;
(2)上述B步骤操作的目的是_______________________;
(3)上述A步骤操作之前,先用待测液润洗锥形瓶,则对滴定结果的影响是______________;
(4)判断到达滴定终点的实验现象是______________________;
(5)若滴定时在晃动锥形瓶的过程中不小心将液体洒出,对实验结果的影响是_______;
(6)若称取一定量的KOH固体(含少量NaOH)配制标准溶液并用来滴定上述盐酸,则对滴定结果产生的影响是__________________________________。
(9分)实验室用如下图所示装置来制备乙炔,并验证乙炔的某些化学性质,制备的乙炔气体中往往含有少量的H2S气体,请按下列要求填空: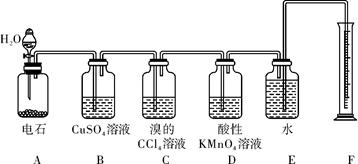
(1)实验室制乙炔的化学方程式是:__________________________________________;为了得到较为平稳的乙炔气流,装置A的分液漏斗中常用____________来代替水。
(2)装置B中CuSO4溶液的作用是______________________________________。
(3)装置C中观察到的现象是_________,反应的化学方程式是:___________________。
(4)装置D中观察到的现象是______________________,该反应的类型是____________。
实验室用溴和苯在FeBr3催化下制取溴苯,得到粗溴苯后,要用如下操作提纯:(1)蒸馏;(2)水洗;(3)用干燥剂干燥;(4)用10%的NaOH溶液洗涤。正确的操作顺序是
| A.(1)(2)(3)(4) | B.(4)(2)(3)(1) |
| C.(4)(1)(2)(3) | D.(2)(4)(2)(3)(1) |
实验室制取少量溴乙烷的装置如下图所示。根据题意完成下列填空: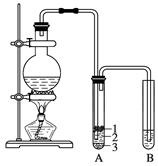
(1)盛放反应物的仪器名称是其中加入的反应物是溴化钠、________和1∶1的硫酸。配制体积比1∶1的硫酸所用的定量仪器为______(选填编号)。
a.烧杯b.量筒c.容量瓶d.滴定管
(2)写出加热时烧瓶中发生的主要反应的化学方程式_________________________。
(3)将生成物导入盛有冰水混合物的试管A中,冰水混合物的作用是________________。
试管A中的物质分为三层(如图所示),产物在第______________________________层。
(4)试管A中除了产物和水之外,还可能存在_________、________(写出化学式)。
(5)用浓的硫酸进行实验,若试管A中获得的有机物呈棕黄色,除去其中杂质的正确方法是______(选填编号)。
a.蒸馏b.用氢氧化钠溶液洗涤
c.用四氯化碳萃取d.用亚硫酸钠溶液洗涤
若试管B中的酸性高锰酸钾溶液褪色,使之褪色的物质的名称是________。
(6)实验员老师建议把上述装置中的仪器连接部分都改成标准玻璃接口,其原因是__________________。
在实验室鉴定氯酸钾晶体和1氯丙烷中的氯元素,现设计了下列实验操作程序:①滴加AgNO3溶液;②加NaOH溶液;③加热;④加催化剂MnO2;⑤加蒸馏水,过滤后取滤液;⑥过滤后取滤渣;⑦用HNO3酸化。
(1)鉴定氯酸钾中氯元素的操作步骤是____________(填序号)。
(2)鉴定1氯丙烷中氯元素的操作步骤是____________(填序号)。
(15分)为了探究乙二酸的不稳定性、弱酸性和还原性,某化学兴趣小组设计了如下实验。
[查阅资料]乙二酸俗称草酸,草酸晶体(H2C2O4·2H2O)在100°C时开始升华,157°C时大量升华 并开始分解;草酸蒸气在低温下可冷凝为固体且草酸钙不溶于水,草酸蒸气能使澄清石灰水变浑浊。
I、乙二酸的不稳定性:
根据草酸晶体的组成,猜想其受热分解产物为CO、CO2和H2O。
(1)请用下列装置组成一套探究并验证其产物的实验装置,
请回答下列问题: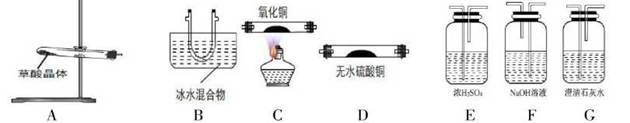
①装置的连接顺序为:A→B→→→F→E→C→G。
②装置中冰水混合物的作用是。
③能证明产物中C0的实验现象是。
④整套装置存在不合理之处为。
Ⅱ、乙二酸的弱酸性:
该小组同学为验证草酸性质需0.1mol·L-1的草酸溶液480ml。
(2)配置该溶液需要草酸晶体g。
(3)为验证草酸具有弱酸性设计了下列实验,其中能达到实验目的是。
| A.将草酸晶体溶于含酚酞的NaOH溶液中,溶液褪色 |
| B.测定0.1molL-1草酸溶液的pH |
| C.将草酸溶液加入Na2CO3溶液中,有CO2放出 |
| D.测定草酸钠溶液的pH |
(4)该小组同学将0.1molL-1草酸溶液和0.1molL-1的NaOH等体积混合后,测定反应后溶液呈酸性,则所得溶液中各离子浓度由大到小的顺序为。
Ⅲ、乙二酸的还原性:
(5)该小组同学向用硫酸酸化的KMnO4溶液中滴入过量的草酸溶液,发现酸性KMnO4溶液褪 色,从而判断草酸具有较强的还原性。该反应的离子方程式为_。