在一个2L的容器内充入6.0mol某气态反应物,经过3s后,它的浓度变成1.2mol/L,在3s内用该反应物浓度的变化表示的反应速率为
| A.0.6mol·L—1·s—1 | B.0.8mol·L—1·s—1 |
| C.0.4mol·L—1·s—1 | D.2.4mol·L—1·s—1 |
下列化合物既能发生消去反应,又能发生水解反应,同时还能发生催化氧化反应的是
| A.CHCl3 | B.CH3CH2Br |
| C.CH2BrCH2CH2OH | D.CH3CH2OH |
等物质的量的下列有机物充分燃烧时,消耗氧气最多的是
| A.甲烷 | B.乙烯 | C.苯 | D.乙醇 |
下面四种变化中,有一种变化与其他三种变化类型不同的是
A.CH3CH2OH + CH3COOH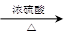 CH3COOCH2CH3 + H2O CH3COOCH2CH3 + H2O |
B.CH3CH2OH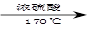 CH2=CH2↑+H2O CH2=CH2↑+H2O |
C.2CH3CH2OH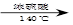 CH3CH2OCH2CH3 + H2O CH3CH2OCH2CH3 + H2O |
D.CH3CH2OH + HBr CH3CH2Br + H2O CH3CH2Br + H2O |
下列化合物中,核磁共振氢谱只出现三组峰且峰面积之比为3:2:2的是
A.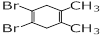 |
B.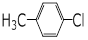 |
C.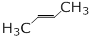 |
D.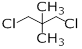 |
下列物质属于醇类的是
A.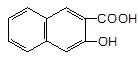 |
B.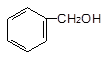 |
C.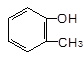 |
D.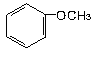 |