下列各组成金属和溶液,能组成原电池的是
| A.Cu、Cu、稀硫酸 | B.Ag、Cu、稀硫酸 |
| C.Cu、Zn、酒精 | D.Zn、Cu、CuSO4溶液 |
下列叙述正确的是
| A.相对分子质量相同的物质一定是同种物质 |
| B.组成上相差(CH2)m的物质一定属于同系物 |
| C.分子式相同的不同物质一定是同分异构体 |
| D.中子数不同质子数相同的微粒一定是同种核素 |
下面的微粒,不属于官能团的是
A.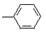 |
B.-OH | C.-COOH | D.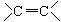 |
下列有关有机物的说法中正确的是
| A.凡是含有碳元素的化合物都属于有机物 |
| B.易溶于汽油、酒精、苯等有机溶剂中的物质,一定是有机物 |
| C.所有的有机物都很容易燃烧 |
| D.大多数有机物都是共价化合物 |
实验室用4molSO2与2molO2在一定条件下进行下列反应:
2SO2(g)+O2(g) 2SO3(g);△H=-197kJ/mol,当放出315.2kJ热量时,SO2的转化率为
2SO3(g);△H=-197kJ/mol,当放出315.2kJ热量时,SO2的转化率为
| A.40% | B.50% | C.80% | D.90% |
已知:2Zn(s)+O2(g)=2ZnO(s)△H=-701.0kJ·mol-1
2Hg(l)+O2(g)=2HgO(s)△H=-181.6kJ·mol-1
则反应Zn(s)+ HgO(s)=ZnO(s)+ Hg(l)的△H为
| A.-259.7 kJ·mol-1 | B.-519.4kJ·mol-1 |
| C.+259.7 kJ·mol-1 | D.+519.4kJ·mol-1 |