甲、乙两位同学分别用不同的方法配制100 mL、3.6 mo1/L的稀硫酸。
(1)若采用18 mo1/L的浓硫酸配制溶液,需要用到浓硫酸的体积为________。
(2)甲同学:量取浓硫酸小心地倒入盛有少量水的烧杯中,搅拌均匀,待冷却至室温后转移到100 mL容量瓶中,用少量的水将烧杯等仪器洗涤2~3次,每次洗涤液也转移到容量瓶中,然后小心地向容量瓶加入水至刻度线定容,塞好瓶塞,反复上下颠倒摇匀。
①将溶液转移到容量瓶中的正确操作是_______________________。
②洗涤操作中,将洗涤烧杯后的洗涤液也注入容量瓶中,其目的是_________________。
③定容的正确操作是 ________________。
④用胶头滴管往容量瓶中加水时,不小心液面超过了刻度,处理的方法是________(填字母序号)。
| A.吸出多余液体,使凹液面与刻度线相切 |
| B.小心加热容量瓶,经蒸发后,使凹液面与刻度线相切 |
| C.经计算加入一定量的浓硫酸 |
| D.重新配制 |
(3)乙同学:用100 mL量筒量取浓硫酸,并向其中小心地加入少量水,搅拌均匀,待冷却至室温后,再加入水至100 mL刻度线,最后搅拌均匀。你认为此法是否正确?若不正确,指出其中错误之处:_________。
(每空2分,共18分)现有A、B、C、D、E五种物质,并存在如下转化关系.其中E为黑色粉末,在下图转化中均作催化剂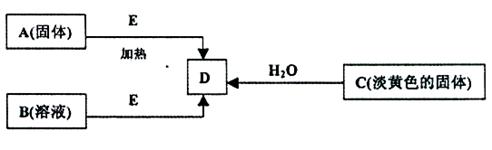
(1)B的化学式
(2)利用下图所示的实验装置进行C与水的反应,回答下列有关同题:
①固体C与水反应生成D的化学方程式为:.
②检验导管出口气体的方法为:.
③烧杯中的现象为:.
(3)在加热条件下,某无氧酸(含有A中的一种元素)的浓溶液与E反应,生成单质气体X.为检验X的性质,设计如下图所示实验装置: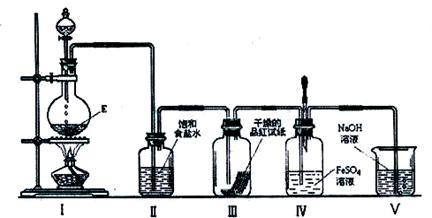
①实验过程中,观察到装置Ⅲ中的品红试纸的红色褪去,并未观察到“无明显变化”这一预期现象.为了达到这一预期现象,你认为应该如何改进?
。
②实验结束后,装置Ⅳ中可观察到现象是 ,若滴加两滴胶头滴管中的试剂,观察到溶液呈血红色,有关的离子方程式为:
, 。
③X是一种重要的化工原料,用化学方程式表示X在化工生产上的一项用途:
。
某化学课外活动小组以铝屑、稀H2SO4、NaOH溶液为主要原料欲制备Al(OH)3沉淀,设计了如下三种方案,见下表。阅读下表并回答下列问题:
| 途径 |
生成1 mol Al(OH)3消耗H+或OH-的物质的量/mol |
|
| 消耗H+ |
消耗OH- |
|
| 1.Al→Al3+→Al(OH)3 |
||
2.Al→AlO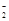 →Al(OH)3 →Al(OH)3 |
||
3.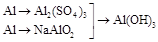 |
(1)填写上表中空格并从节约原料的角度来分析,你认为应选择方案_________最为合理。
(2)本实验要用到NaOH溶液。某学生用已知质量y(g)的表面皿,准确称取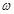 (g)NaOH固体。他在托盘天平的右盘上放入(
(g)NaOH固体。他在托盘天平的右盘上放入(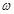 + y)(g)砝码,在左盘的表面皿中加入NaOH固体,这时指针偏向右边,如图所示,下面他的操作应该是_________使。
+ y)(g)砝码,在左盘的表面皿中加入NaOH固体,这时指针偏向右边,如图所示,下面他的操作应该是_________使。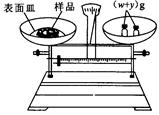
(3)若称取的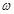 (g)NaOH刚好可配制0.5mol·L-1NaOH溶液500mL。在下列配制溶液过程示意图中有错误的是(填操作序号)______________。
(g)NaOH刚好可配制0.5mol·L-1NaOH溶液500mL。在下列配制溶液过程示意图中有错误的是(填操作序号)______________。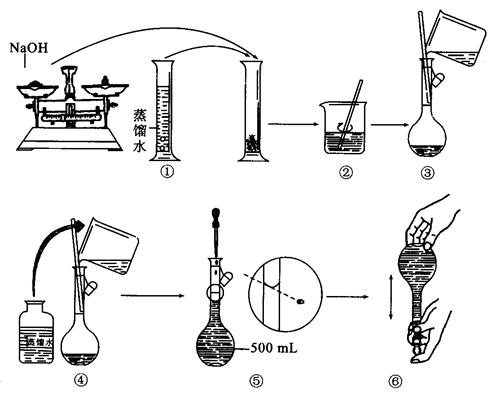
(4)阅读下列制备Al(OH)3实验步骤,填写空白:
①在烧杯A中加入50mL0.5mol·L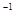 NaOH溶液,再加入足量铝屑。给溶液稍加热。其作用是:__________________________用蒸馏水把铝屑冲洗干净。称量铝屑的质量为m1(g)。
NaOH溶液,再加入足量铝屑。给溶液稍加热。其作用是:__________________________用蒸馏水把铝屑冲洗干净。称量铝屑的质量为m1(g)。
②在盛有适量稀H2SO4的烧杯B中应放入___________(g)(用含m1的式子表示)质量的铝屑,充分搅拌使铝屑反应完全。
③在盛有适量浓NaOH溶液的烧杯C中放入____________(g)(用含m1的式子表示)质量的铝屑充分搅拌使铝屑反应完全。
④将烧杯B和烧杯C中的溶液混和观察到的现象是:_______________________________,反应的离子方程式是:___________________________
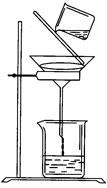
(5)过滤时某学生操作如图,请用文字说明图中错误的是:
_____________________。
(6)把沉淀转移到烧杯中,用蒸馏水洗涤三次再过滤,再洗涤、
干燥得Al(OH)3固体质量为m2(g)计算本实验Al(OH)3的产率是_________________
(1)题每空1分,(1)题3分,其余各2分,共15分)
某校化学课外活动小组利用下面所提供的仪器装置和药品制取NaHCO3溶液,设计如下实验。实验室提供如下药品:①2%NaOH溶液②稀HCl③稀H2SO4④饱和KHCO3溶液⑤浓H2SO4⑥CaCO3固体⑦K2CO3粉末⑧纯水。提供如下仪器装置: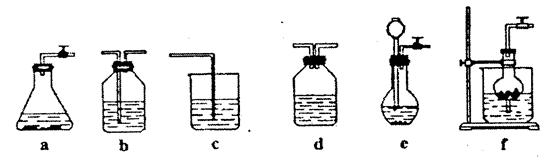
请根据题目要求回答下列问题:
(l)请按下表要求,填写选择的装置和药品
| 分项 内容 |
CO2发生装置(X) 随开随用,随关随停 |
除杂洗气装置(Y) |
制备产品装置(Z) |
| 选择的装置(填序号) |
C |
||
| 选择的药品(填序号) |
① |
(2)如何检验所选择的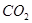 发生装置(X)的气密性,请写出主要操作过程:
发生装置(X)的气密性,请写出主要操作过程:
_____________________________________________________________________________
__________________________________________________________________________。
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为________________,Y装置中除去的杂质为_____________,
(4)常温下,向Z装置的NaOH溶液中通入过量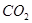 气体,其原因是_________________;通入过量
气体,其原因是_________________;通入过量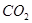 后,Z装置内的溶液中离子浓度大小顺序为:_______________________。
后,Z装置内的溶液中离子浓度大小顺序为:_______________________。
某兴趣小组同学共同设置了如图所示的实验装置,既可用于制取气体,
又可用于验证物质的性质。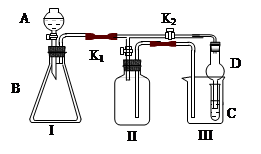
(1)利用I、II装置制取气体(K2闭,K1打开)甲同学认为:利用II装置可以收集H2、NH3等气体,但不能收集O2和NO 等气体,其理由是:__________________________________
____________________________________________________________________
乙同学认为:利用II装置作简单改进,(不改变仪器装置),也可收集O2和NO等气体,但不能收集NO2气体,改进的方法是_______________________,利用II装置再作简单改进(不改变仪器装置),还可收集NO2气体,改进方法___________________________。
(2)利用I、III装置验证物质的性质(K2打开,K1关闭),如设计证明氧化性:KMnO4>Cl2>Br2,则在A中加浓盐酸,B中加___________,C中加_________,观察到C中的现象是__________________。
(3) 请利用I、III 装置自行设计有机实验,写出实验所用的试剂,简述C中的实验现象及根据此现象所得结论。
A中加___________,B中加___________,C中加____________
现象:____________________,结论:_________________________________________。
在实验室中学生用下左图装置制取乙酸乙酯。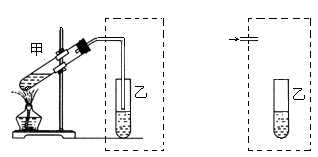
写出该反应的化学方程式______________________________。
回答下列问题:
(1)在大试管中加入浓硫酸3mL、冰醋酸3mL(3 g)、乙醇4mL(2.7 g),加入试剂的正确操作是__________________________________。
(2)装置中通蒸汽的导管只能插到饱和碳酸钠溶液的液面上方,不插入溶液中,作用是__________,长导管的作用是_______________。试设计另一个装置也能实现上述两个作用,在虚线部分画出该装置简图。
(3)试管乙中的现象是_______ ,由此可知乙酸乙酯的物理性质有_________________ 。
(4)充分反应后,制得乙酸乙酯的质量_______________g。
(5)工业用石油裂解气的主要成分为原料制取乙酸乙酯,经过的反应类型(按反应顺序)是_________________________。