强电解质甲、乙、丙、丁分别溶于水,电离出NH4+、Ba2+、H+、Mg2+、OH—、Cl—、HCO3—、SO42—。(每种溶液中溶质电离出的离子各不相同)。已知:①甲溶液分别与其它三种溶液混合,均产生白色沉淀;②0.1mol/L乙溶液中c(H+)>0.1mol/L;③向丙溶液中滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀。下列结论不正确的是( )
| A.四种物质中一定有共价化合物 |
| B.四种物质中一定有Ba(OH)2 |
| C.丙溶液中含有NH4+ |
| D.丁溶液中含有HCO3— |
下列说法错误的是
| A.分馏汽油和裂化的汽油中加入溴的四氯化碳溶液均能发生反应 |
| B.含C18以上烷烃的重油经过催化裂化可以得到汽油 |
| C.石油分馏的装置中,温度计水银球应放在蒸馏烧瓶支管口附近 |
| D.石油中含有C5~C11的烷烃,可以通过石油的分馏得到汽油 |
能说明苯分子中碳碳键不是单、双键交替的事实是
①苯不能使KMnO4溶液褪色;
②苯环中碳碳键的键长均相等;
③邻二氯苯只有一种;
④在一定条件下苯与H2发生加成反应生成环己烷。
| A.①②③④ | B.①②③ | C.②③④ | D.①②④ |
下列有机物分子中,所有原子不可能在同一平面上的是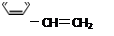
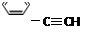
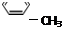 A.
A. B. C.D.
B. C.D.
图1和图2是A、B两种物质的核磁共振氢谱。已知A、B两种物质都是烃类,都含有6个氢原子。请根据图1和图2两种物质的核磁共振氢谱谱图选择出可能属于图1和图2的两种物质是

图1 A的核磁共振氢谱图2 B的核磁共振氢谱
A.A是C3H6;B是C6H6B.A是C3H6;B是C2H6
C.A是C2H6;B是C6H6D.A是C2H6 ;B是C3H6
按照系统命名法,下列有机物命名正确的是
A.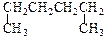 1,4-二甲基丁烷 1,4-二甲基丁烷 |
B. 2-甲基丁烯 2-甲基丁烯 |
C. 2-甲基丁烷 2-甲基丁烷 |
D.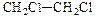 二氯乙烷 二氯乙烷 |