已知反应:CO(g) +3H2 (g)  .CH4 (g)+H2O(g)。起始以物质的量之比为1:1充人反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为)。下列有关说法正确的是
.CH4 (g)+H2O(g)。起始以物质的量之比为1:1充人反应物,不同压强条件下,H2的平衡转化率随温度的变化情况如图所示(M、N点标记为)。下列有关说法正确的是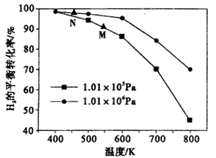
| A.上述反应的△H<0 |
| B.N点时的反应速率一定比M点快 |
| C.降低温度,H2的转化率可达到100% |
| D.工业用此法制取甲烷应采用更高的压强 |
某校研究性学习小组利用铁生锈原理设计了一个可给收音机供电的装置。在此装置中,下列说法正确的是()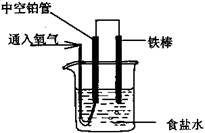
| A.0.1mol Fe完全反应,转移电子0.3mol |
| B.铁作阴极 |
| C.正极反应式为:O2+2H2O+4e-=4OH- |
| D.溶液中的Cl-移向正极 |
(2008菏泽期终,14)杠杆AB两端分别挂有体积相同、质量相同的空心铜球和空心铁球,调节杠杆使其在水中保持平衡,然后小心地向烧杯中央滴入浓CuSO4溶液,一段时间后,下列有关杠杆的偏向判断正确的是(实验过程中不考虑铁铁丝反应及两边浮力的变化)()
| A.杠杆为导体和绝缘体时,均为A端高B端低 20070321 |
B.杠杆为导体和绝缘体时,均为A端低B端高 |
C.当杠杆为绝缘体时,A端低B端高;为导体时,A端高B端低 |
| D.当杠杆为绝缘体时,A端高B端低;为导体时,A端低B端高 |
(2008广东四校水平测试,13)如右图所示的两个实验装置中,溶液的体积均为200mL,开始时电解质溶液的浓度均为0.1mol/L,工作一段时间后,测得导线中均通过0.02mol电子,若不考虑盐的水解和溶液体积的变化,则下列叙述中正确的是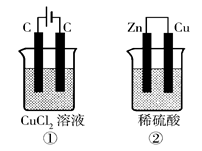
| A.产生气体的体积:①>② |
| B.溶液的pH变化:①减小,②增大 |
| C.电极上析出物质的质量:①>② |
| D.电极反应式:①中阳极 2Cl--2e-Cl2 ↑ ②中负极 2H++2e-H2↑ |
用惰性电极电解一定浓度的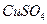 溶液时,通电一段时间后,向所得的溶液中加入0.1mol
溶液时,通电一段时间后,向所得的溶液中加入0.1mol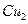 (
(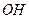 )
)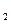
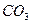 后恰好恢复到点解前的浓度和
后恰好恢复到点解前的浓度和 (不考虑二氧化碳的溶解)。则电解过程中转移的电子的物质的量为
(不考虑二氧化碳的溶解)。则电解过程中转移的电子的物质的量为
| A.0.4mol | B.0.5mol | C.0.6mol | D.0.8mol |

A.1.0L0.1mol/L的NH4Cl溶液中NH4+的个数为0.1NA |
B.常温下,Cu-Zn原电池中,正极产生1.12LH2时,转移的电子数为0.1NA |
C.常温下,0.05molCO2和SO2混合气体中所含氧原子数为0.1NA |
D.高温高压下,1.4 g N2与0.3 g H2反应,生成的NH3分子数为0.1NA |