某密闭容器中充入等物质的量的气体A和B,一定温度下发生反应A(g)+xB(g) 2C(g),达到平衡后,若每次只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是
2C(g),达到平衡后,若每次只改变反应的一个条件,测得容器中物质的浓度、反应速率随时间变化如下图所示。下列说法中正确的是
| A.第8min时 A的反应速率为0.08mol·L-1·min-1 |
| B.在0-54分钟的反应过程中该可逆反应的平衡常数始终为4 |
| C.30min时改变的条件是降低温度,40min时改变的条件是升高温度 |
| D.反应方程式中的x=1,且正反应为放热反应 |
HA和HB两种酸的溶液分别加水稀释时,pH变化的简图如图所示,下列叙述中不正确的是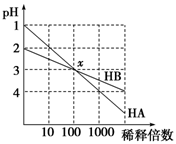
| A.HA是一种强酸 |
| B.x点,[A-]=[B-] |
| C.HB是一种弱酸 |
| D.原溶液中HA的物质的量浓度为HB的10倍 |
下列依据热化学方程式得出的结论正确的是
| A.已知C(石墨,s)=C(金刚石,s) ΔH>0,则金刚石比石墨稳定 |
| B.已知C(s)+O2(g)=CO2(g) ΔH1 C(s)+1/2O2(g)=CO(g);ΔH2,则ΔH2>ΔH1 |
| C.已知2H2(g)+O2(g)=2H2O(g) ΔH=-483.6 kJ/mol,则氢气的燃烧热为241.8 kJ/mol |
| D.已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.3 kJ/mol,则含20 g NaOH的稀溶液与稀盐酸完全中和,中和热为28.65 kJ/mol |
下列说法正确的是
| A.Na2CO3溶液中c(Na+)与c(CO32—)之比为2:1 |
| B.pH=2与pH=1的硝酸中c(H+)之比为1:10 |
| C.0.2 mol•L-1与0.1mol/L醋酸中c(H+)之比为2:1 |
| D.相同体积的0.1 mol•L-1盐酸和0.1mol/L醋酸分别与足量镁条反应,放出H2的体积比大于1:1 |
下列各组离子在指定溶液中能大量共存的是
①无色溶液中:K+、Na+、MnO4-、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、SO42-、NH4+
④由水电离出的c(OH-)=10-13mol·L-1的溶液中:Na+、Ba2+、Cl-、Br一
⑤有较多Fe3+的溶液中:Na+、H+、SCN-、HCO3-
⑥酸性溶液中:Fe2+、Al3+、NO3-、I-、Cl—
| A.①② | B.③⑥ | C.②④ | D.⑤⑥ |
100mL 0.2 mol/L NH4Cl溶液,测其pH为a。加蒸馏水稀释至1L后,溶液有关变化错误的是
| A.c(NH4Cl)变为0.02mol/L | B.水的电离程度变大 |
| C.n(Cl-)无变化 | D.pH小于a+1 |