过氧化氢和臭氧都是常见的绿色氧化剂,在工业生产中有着重要的用途。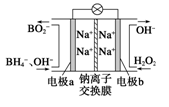
(1)据报道以硼氢化合物NaBH4(B为+3价)和H2O2作原料的燃料电池,可用作通信卫星电源。负极材料采用Pt或C,正极材料采用MnO2,其工作原理如图所示。该电池放电时正极的电极反应式为_________________________;MnO2除了作正极材料外,还可能对电极反应具有_________________作用。
(2)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂。已知:
N2H4(l)+O2(g)===N2(g)+2H2O(g),ΔH=-534 kJ·mol-1
H2O2(l)===H2O(l)+O2(g),ΔH=-98 kJ·mol-1
H2O(l)===H2O(g),ΔH=+44 kJ·mol-1
试写出N2H4和液态H2O2反应生成气态水的热化学方程式___________________。
(3)O3可由臭氧发生器(原理如右图所示)电解稀硫酸制得。
①图中阴极为___________(填“A”或“B”)。
②若C处不通入O2,A极的电极反应式为_________________。
③若C处通入O2,则A极的电极反应式为_________________。
(4)新型O3氧化技术对燃煤烟气中的NOx和SO2脱除效果显著,锅炉烟气中的NOx 95%以上是以NO形式存在的,可发生反应NO(g)+O3(g) NO2(g)+O2(g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的示意图如图所示。由图可得出的正确说法是________。
NO2(g)+O2(g)。在一定条件下,将NO和O3通入绝热恒容密闭容器中发生上述反应,正反应速率随时间变化的示意图如图所示。由图可得出的正确说法是________。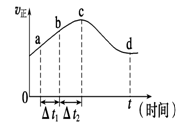
a.反应在c点达到平衡状态
b.反应物浓度:b点小于c点
c.该反应为放热反应
d.Δt1=Δt2时,NO的转化量:a~b段小于b~c段
(12分)用下面两种方法可以制得白色的Fe(OH)2沉淀。
方法一:用不含Fe3+的FeSO4溶液与用不含O2的蒸馏水配制的NaOH溶液反应制备。
(1)用硫酸亚铁晶体配制上述FeSO4溶液时还需加入稀H2SO4和______。
(2)除去蒸馏水中溶解的O2常采用____________的方法。
(3)生成白色Fe(OH)2沉淀的操作是用长滴管吸取不含O2的NaOH溶液,插入FeSO4溶液液面下再挤出NaOH溶液。这样操作的理由是_______________________________。
方法二:在如图所示装置中,用NaOH溶液、铁屑、稀H2SO4等试剂制备。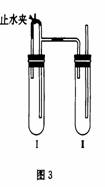
(1)在试管工里加入的试剂是_______________。
(2)在试管Ⅱ里加入的试剂是_______________。
(3)为了制得白色Fe(OH)2沉淀,在试管Ⅰ和Ⅱ中加入试剂,打开止水夹,塞紧塞子后的实验步骤是_________________________________。
(4)这样生成的Fe(OH)2沉淀能较长时间保持白色,其理由是________________________________________________________________。
(16 分)某铝合金(硬铝)中含有铝、镁、铜、硅,为了测定该合金中铝的含量,有人设计了如下实验: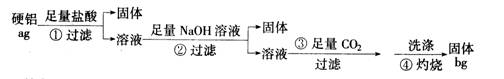
(1)补全上述①②③④各步反应的离子方程式
①Mg+2H+===Mg2++H2↑ , ___________________________
②_______________________, _______________________
Mg2++OH-===Mg(OH)2↓
③ ___________________________________
CO2+H20+ A102-===Al(OH)3↓+3HCO3-
④2A1(OH)3===Al203+H20
(2)该样品中铝的质量分数是()
(3)第②步中加入Na0H溶液不足时,会使测定结果()
第④步中的沉淀没有用蒸馏水洗涤时,会使测定结果()
第④步对沉淀灼烧不充分时,会使测定结果()
A.偏高 B.偏低 C.不影响
(6 分)某研究学习小组在做过氧化钠与水反应实验时,发现过氧化钠与水反应后的溶液滴加酚酞呈红色,但不久红色褪去。甲、乙、丙三个同学对此现象分别做了如下推测:
甲:因为反应后试管很热,所以很可能是溶液温度较高使红色褪去。
乙:查阅资料上载“酚酞在浓的碱溶液中因生成三钠盐而呈无色。”实验所加的水较少,红色褪去可能是生成的氢氧化钠溶液浓度较大的影响。
丙:过氧化钠具有强氧化性,生成物中O2 、H2O2(可能产物)等也具有强氧化性,可能是氧化漂白了红色物质。
(1)验证甲是否正确的方法是_________________________
(2)验证乙是否正确的方法是_________________________
将下列离子Na+、K+、Cu2+、H+、NO3-、Cl-、CO32-、OH-按可能大量共存于同一溶液的情况,把他们分成A、B两组,而且每组中均含两种阳离子和两种阴离子。
A组:
B组:
过氧化氢H2O2,(氧的化合价为-1价),俗名双氧水,医疗上利用它有杀菌消毒作用来清洗伤口。对于下列A~D涉及H2O2的反应,填写空白:
| A.Na2O2 +2HCl= 2NaCl+H2O2 | B.Ag2O+ H2O2=2Ag+O2+ H2O |
| C.2 H2O2="2" H2O+O2 | D.3 H2O2+Cr2(SO4)3+10KOH=2K2CrO4+3K2SO4+8 H2O |
(1)H2O2仅体现氧化性的反应是(填代号)。
(2)H2O2既体现氧化性又体现还原性的反应是(填代号)。
(3)H2O2体现酸性的反应是(填代号)。
(4)上述反应说明H2O2、Ag2O、K2CrO4氧化性由强到弱的顺序是:。