已知Cr(OH) 3在碱性较强的溶液中将生成[Cr(OH)4]―,铬的化合物有毒,由于+6价铬的强氧化性,其毒性是+3价铬毒性的100倍。因此,必须对含铬的废水进行处理,可采用以下两种方法。
还原法在酸性介质中用FeSO4等将+6价铬还原成+3价铬。 具体流程如下:
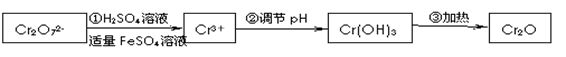
有关离子完全沉淀的pH如下表:
| 有关离子 |
Fe2+ |
Fe3+ |
Cr3+ |
| 完全沉淀为对应氢氧化物的pH |
9.0 |
3.2 |
5.6 |
(1)写出Cr2O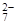 与FeSO4溶液在酸性条件下反应的离子方程式__________________。
与FeSO4溶液在酸性条件下反应的离子方程式__________________。
(2)在含铬废水中加入FeSO4,再调节pH,使Fe3+和Cr3+产生氢氧化物沉淀。
则在操作②中可用于调节溶液pH的试剂最好为:_____________(填序号);
A.Na2O2 B.Ca(OH)2 C.Ba(OH)2 D.NaOH
此时调节溶液的pH范围在____________(填序号)最佳。
A.12~14 B.10~11 C.6~8 D.3~4
(3)将等体积的4.0×10-3mol·L-1的AgNO3和4.0×10-3mol·L-1的K2CrO4溶液混合能析出Ag2CrO4沉淀(Ksp(Ag2CrO4)=9.0×10-12),请写出表示Ag2CrO4溶解平衡的方程式,并简要写出能生成Ag2CrO4沉淀原因的计算过程。
互为同分异构体的有机物A、B、C的分子式均为C5H8O2,其中A为直链结构,加热时能与新制的氢氧化铜浊液反应,生成砖红色物质;A分子中核磁共振氢谱图中有三组峰,且峰面积之比为2∶1∶1。B为五元环酯。C的红外光谱表明其分子中存在甲基。A ~ I等有机物的转化关系如下:
己知:烯烃在一定条件下可与卤素单质发生α-H原子的取代反应。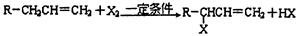
(1)A、B的结构简式分别是:A_______________,B_______________。
(2)C为反式结构,其结构式为_______________。
(3)写出下列反应的化学方程式:
O→C:_____________________________________________。
G→H:____________________________________________________。
(4)写出下列反应类型:
F→G_______________,A→I的①_______________。
(5)写出F发生加聚反应生成的产物的结构简式____________________________。
(6)写出与A互为同系物的任意一个物质的结构简式为______________________。
短周期元素X、Y、Z、W原子序数依次增大。X氢化物的水溶液显碱性;Y在元素周期表中所处的周期序数与族序数相等;Z单质是将太阳能转化为电能的常用材料;W是重要的“成盐元素”,主要以钠盐的形式存在于海水中。请回答:
(l)Y在元素周期表中的位置是__________;X氢化物的电子式是__________。
(2)X氢化物的水溶液与W氢化物的水溶液混合后恰好反应时,溶液呈__________(填“酸”、“碱”或“中”)性,用离子方程式表示其原因是__________。
(3)Y-AgO电池是应用广泛的鱼雷电池,其原理如下图所示。
该电池的负极反应式是__________。
(4)Z和W比较,非金属性较弱的是__________(填元素符号),下列可以验证这一结论的是__________(填序号)。
a.元素在地壳中的含量
b.最高价氧化物对应水化物的酸性
c.断开氢化物中1molH-Z或H-W键所需的能量
d.Z与W以共价键形成化合物时,Z或W显示的电性
I.设反应①Fe(s)+CO2(g) FeO(s)+CO(g)的平衡常数为K1。反应②Fe(s)+H2O(g)
FeO(s)+CO(g)的平衡常数为K1。反应②Fe(s)+H2O(g)  FeO(s)+H2(g)的平衡常数为K2,在不同温度下,K1、K2的值如下:
FeO(s)+H2(g)的平衡常数为K2,在不同温度下,K1、K2的值如下:
| T(K) |
K1 |
K2 |
| 973 |
1.47 |
2.36 |
| 1173 |
2.15 |
1.67 |
(1)现有反应③CO2(g)+H2(g)  CO(g)+H2O(g),这是一个(填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有(填序号)。
CO(g)+H2O(g),这是一个(填“吸”或“放”)热反应,要使平衡③向右移动,可采取的措施有(填序号)。
A.缩小反应容器容积
B.扩大反应容器容积
C.降低温度
D.升高温度
E.使用合适的催化剂
F.设法减少CO的量
(2)若反应Fe(s)+CO2(g)  FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)
FeO(s)+CO(g)在温度T1下进行;Fe(s)+H2O(g)  FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率(填序号)。
FeO(s)+H2(g)在温度T2下进行,已知T1>T2,且c(CO2)>c(H2O)(其他条件均相同),则两者的反应速率(填序号)。
A.前者大B.后者大C.一样大D.无法判断
II.(1)钢铁的表面发蓝、发黑处理是常用的防腐方法。请配平主要反应的方程式:
□Na2FeO2+□NaNO2+□H2O=□NaFeO2+□NH3↑+□NaOH
(2)钢铁经冷、浓HNO3处理后“钝化”能达到防腐目的,不同浓度的HNO3与铁反应的还原产物很复杂,其分布曲线如图。
①图示可知,分析HNO3与铁反应的规律是。
②工业上一般不用冷浓硝酸进行铁表面处理,其可能的原因是。
(3)金属(M)的腐蚀是因为发生反应:M-ne-→Mn+,除了上述表面处理的方法外,下列方法也能起到防腐作用的是(填字母编号)
A.在铁中掺入铬等金属制成不锈钢
B.在铁制品表面镀锌
C.提高铁中含碳量,制成生铁
D.将水库铁闸门与直流电源的负极相连
苯酚是重要的化工原料,通过下列流程可合成阿司匹林、香料和一些高分子化合物。
已知:
(1)写出反应类型:①,④。
(2)写出反应的条件⑤,⑦。
(3)写出C的结构简式,其中含氧官能团是,B的结构简式。
(4)下列可检验阿司匹林样品中混有水杨酸的试剂是。
(a)三氯化铁溶液 (b)碳酸氢钠溶液 (c)石蕊试液
(5)写出反应③的化学方程式。
(6)写出反应⑧的化学方程式。
有①、②、③、④、⑤、⑥、⑦、⑧、⑨、⑩十种元素,原子序数依次增大,⑨、⑩处于第四周期,其余均为短周期元素。
(1)若②、⑦、⑧三种元素在周期表中相对位置如下
| ② |
|||
| ⑦ |
⑧ |
②与⑧形成的液体化合物是常见的溶剂,则⑦元素在周期表中的位置是,②元素的氧化物的电子式是,②与⑧形成的化合物中存在的化学键是,则②、⑦、⑧三种元素最高价氧化物对应的水化物酸性由弱到强的顺序是(用化学式表示)。⑦、⑧两种元素形成的阴离子半径大小顺序是(用离子符号填)。
(2)若甲、己、丙、丁、戊均为上述短周期元素中组成的单质或化合物,且甲、乙、丙为无色气体,戊为红棕色气体。根据下图所示转化关系推测:
①写出反应a的化学方程式:。
②写出戊与丁反应的化学方程式:。
(3)若下图中A、B、C、D、E分别是上述10种元素组成的单质或化合物。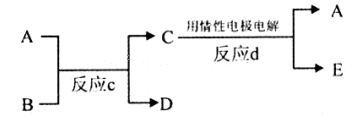
①若反应c是用A作电解池的阳极,电解B的水溶液,其中A是红色金属单质,E是具有黄绿色的气体。则反应d中阴极的电极反应式为:。
②若反应c是在高温下进行的。其中B是暗红色固体,当物质C是一种两性化合物,则反应c的化学方程式为。