小艾在实验室观察完品红扩散实验后,想把变红的水做一个简单的处理后再排入下水道。请根据下图相关信息,回答下列问题:

(1)图1实验证明了分子具有 的性质;
(2)图2过滤操作中必须用到的玻璃仪器分别是漏斗、 、烧杯,该操作过程中共有 处错误,
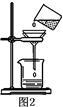
(3)小艾同学将红色液体按过滤的正确操作完成后,发现过滤后的液体中仍有少量品红固体,则造成这种情况可能的原因是 。
| A.滤纸破损 | B.滤渣过多 |
| C.滤纸与漏斗间有气泡 | D.液面高于滤纸边缘 |
(4)经过重新过滤后,水中的品红固体已完全除尽。此时小艾想让水变得无色透明,应该选择的另一种净水方法是 。
(5)小刘同学拿来了下列几个简易净水装置。若对浑浊的泥水进行净化,你认为净水效果最快最好的装置是 。
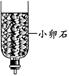
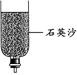
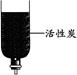

A B C D
食盐是生活必需品,也是重要的化工原料。
(1)电解饱和食盐水可以得到多种化工产品,主要过程如下:
①气体A是密度最小的气体,该气体的名称为,写出一个由酸D转化为气体A的化学方程式。
②电解后生成的碱B的化学式为,你猜想的依据是。
(2)食盐中含有各种添加剂,如添加碘酸钾(KIO3)补充碘元素、添加亚铁氰化钾(K4[Fe(CN)6]·3H2O) 作为抗结剂防止食盐结块。但人们总是担心抗结剂会分解产生剧毒物质氰化钾(KCN)。某同学对此进行了探究,其热重分析数据如图: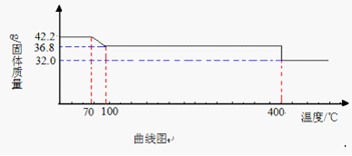
【查阅资料】一般烹饪温度低于340℃。
回答下列问题:
①食盐中至少含有种金属元素(填一数字)。
②写出70℃~100℃反应的方程式;
当温度高于400℃时,会产生剧毒物质KCN,同时还会产生一种单质气体,则X的化学式是。
③食用含亚铁氰化钾作抗结剂的食盐是否安全?其理由是。
请结合图示实验装置,回答下列问题。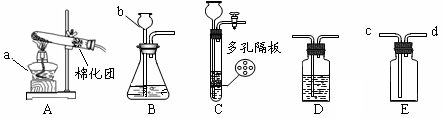
(1)图中a、b仪器的名称:a,b。
(2)用高锰酸钾固体制氧气,选用的发生装置是(填“A”、“B”或“C”),装入药品前应先进行的操作是,反应的化学方程式是。
(3)某同学在实验室用C装置(多孔隔板用来放块状固体)制取CO2,反应的化学方程式为, C装置与B装置相比较,优点为(答出一点即)。
(4)实验室用B装置制取H2时,b中应加入。如要获得干燥的气体,除发生装置外,还应选用盛放(填写试剂名称)的D装置。如用E装置收集H2,则气体应从端通入(填“c”或“d”)。
为研究锌和铝的金属活动性,某研究小组进行了如下探究。
(1)小明设计的实验方案:向表面积相同的铝片和锌粒中分别加入盐酸。写出锌与盐酸反应的化学方程式。
(2)小芳将去膜和未去膜的铝片分别放入盐酸中,发现前者比后者反应快,原因是
。
(3)小芳在(2)实验中,还观察到有“灰黑色沉淀”这一异常现象出现。
【提出问题】铝与盐酸反应出现的灰黑色沉淀的组成是什么?
【查阅文献】铝在颗粒较小时为灰黑色;AlCl3为无色透明晶体或白色而微带浅黄色的固体,易溶于水和乙醇。
【提出合理假设】假设a:该灰黑色沉淀可能含有;
假设b:该灰黑色沉淀可能含有AlCl3;
假设c:该灰黑色沉淀可能含有难溶于酸的物质。
【设计并完成实验】取灰黑色沉淀分别进行如下实验。
| 实验编号 |
实验操作 |
实验现象 |
| ① |
加入适量稀盐酸 |
有微量气泡,固体全部溶解,得到澄清溶液 |
| ② |
加入适量蒸馏水 |
固体部分溶解 |
| ③ |
加入适量无水乙醇 |
固体部分溶解 |
【得出结论】由实验①可判断假设c(填“成立”或“不成立”),再集合②和③可得出该灰黑色沉淀的成分是。
(4)你认为①中小明的实验能否比较锌和铝的金属活动性强弱?(填“能”或“不能”),分别从设计方法和操作可行性的角度,具体说明理由
。
做完“铁在氧气里燃烧”实验后,某兴趣小组有一些疑惑不解的问题,于是他们进行了以下探究活动,请你一同参与。
[问题1] 细铁丝在氧气中燃烧为什么会“火星四射”?
[查阅资料1]①日常生活中的钢铁制品都含有少量碳杂质。 ②含碳细铁丝燃烧时,其中的炭粒生成的CO2气体在熔融液态物质中形成气泡,熔融液态物质因气泡炸裂引起“火星四射”的现象。
[设计实验]为了探究细铁丝在纯氧中燃烧产生“火星四射”现象的原因,该小组同学设计的实验方案是:取长短粗细相同的含碳细铁丝和不含碳的细铁丝,分别在足量的氧气中燃烧,观察现象。你认为他们的方案(填“合理”或“不合理”)。
[实验探究1]小明做细铁丝在氧气中的燃烧实验时,他把细铁丝绕成螺旋状,一端系在一根铁丝上,另一端系上一根火柴。点燃火柴后迅速把铁丝连同火柴一起插入集气瓶下部(没有接触到细沙,如图所示),但不见铁丝燃烧,反复实验均未成功。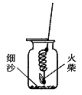
该同学认为可能导致失败的原因主要有三种:
A.铁丝表面有锈迹,影响了反应的进行;
B.点燃火柴后立即将它伸入瓶内,火柴燃烧消耗了氧气,不利于铁丝的燃烧;
C.火柴燃烧时有大量的热量放出,将铁丝和火柴迅速伸至集气瓶下部,因热胀冷缩之故。瓶内氧气会膨胀逸出,使铁丝无法燃烧。
实验:根据以上假设,他对实验应作的相应改进为:
(1);(2);(3) 。
[问题2]铁燃烧时溅落下来的黑色物质中还有没有铁呢?
[查阅资料2] ①自然界中铁的氧化物主要是Fe3O4和Fe2O3两种(FeO极易被氧化为Fe2O3);②铁的氧化物均能溶于酸的溶液。
[实验探究2]将冷却后的黑色物质碾碎,装入试管,加入_____溶液,观察到的现象是_____,说明铁燃烧时溅落下来的黑色物质中还含有铁。
[问题3]铁燃烧的产物为什么不是Fe2O3呢?
[查阅资料3]①Fe3O4和Fe2O3的分解温度、铁的熔点见表:②Fe2O3高温时分解成Fe3O4。
| Fe3O4 |
Fe2O3 |
铁 |
|
| 分解温度/℃ |
1538 |
1400 |
— |
| 熔点/℃ |
— |
— |
1535 |
[理论探讨]
根据实验现象,并结合表中数据,可推知铁在氧气里燃烧时产生的高温应在_____之间,在此温度范围内Fe2O3已分解,所以铁在氧气里燃烧的产生是Fe3O4。
[拓展延伸]
(1)小林同学发现“铁丝”在纯净氧气中燃烧起来,观察到火星四射,并有黑色固体生成,请写出该反应的化学方程式;
(2)Fe2O3高温时会分解成Fe3O4和一种气体,请写出此反应的化学方程式__________;
(3)有些超市的食品密封包装盒的透明盖内放有黑色的FeO粉末,若粉末的颜色_____,就说明包装盒破损进气,这样售货员就能及时发现并处理。
甲同学在某食品包装袋内,发现有一个装有白色颗粒状固体A的小纸袋,上面写着“生石灰干燥剂,请勿食用”。甲同学随手将小纸袋拿出来放在空气中,经过一段时间后,发现纸袋内的白色颗粒粘在一起成为块状固体B。请你与甲同学一起对块状固体B进行探究。
⑴猜想一:块状固体B中除氧化钙外还可能有:、。
写出白色颗粒状固体A在空气中转化为块状固体B的化学反应方程式:
;。
⑵猜想二:块状固体B溶于水可能有现象(填“放热”或“吸热”)。
⑶取适量块状固体B加入盛有一定量水的试管中,振荡、静置、过滤,得到少量白色固体C。就白色固体C的成分,甲同学与乙同学进行讨论,一起猜想。
甲同学认为,白色固体C可能是:氢氧化钙;乙同学认为,白色固体C可能是:碳酸钙;
你认为,白色固体C还可能是:。
请设计实验证明你的猜想(填写下表):
| 方案 |
现象和结论 |