已知温度T时水的离子积常数为Kw,该温度下,将浓度为a mol/L的一元酸HA与bmol/L的一元碱BOH等体积混合,可判断溶液呈中性的依据是
| A.a = b |
| B.混合溶液中,c(H+) + c(B+) = c(OH-) + c(A-) |
C.混合溶液中,c(H+) =  |
| D.混合溶液的pH = 7 |
广口瓶被称为气体实验的“万能瓶”,是因为它可以配合玻璃管和其他简单仪器组成各种功能的装置。下列各图中能用作防倒吸安全瓶的是( )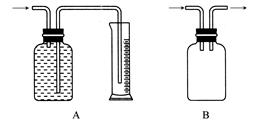

下列实验问题的处理方法中,正确的是( )
| A.实验中不慎打破温度计,可用吹风机吹风加快水银(Hg)的挥发 |
| B.在气体发生装置上直接点燃甲烷(CH4)气体时,必须先检验甲烷的纯度 |
| C.实验结束后,将废液倒入下水道排出实验室,以免污染实验室 |
| D.制取NH3实验中,将多余NH3用导管直接导入水槽,用水吸收 |
下列试剂保存方法不正确的是( )
| A.AgNO3存放在棕色瓶中 |
| B.用铝制容器装运浓硝酸 |
| C.少量白磷保存在水中 |
| D.溴水存放在带橡胶塞的玻璃瓶中 |
对于易燃、易爆、有毒的化学物质,往往会在其包装上贴以下危险警告标签。下面所列物质中,贴错了标签的是( )
| A |
B |
C |
D |
|
| 物质的 化学式 |
HNO3(浓) |
CCl4 |
KCN |
KClO3 |
| 危险警告标签 |
 腐蚀品 |
 易燃品 |
 剧毒品 剧毒品 |
 爆炸品 爆炸品 |
上海教师公寓大火与施工中大量使用的聚氨酯燃烧有关,再次表明HNHCOOH(聚氨酯)泡沫保温材料等易燃装修材料已经成为造成火灾的罪魁祸首,下列有关说法正确的是( )
| A.聚氨酯保温材料能耐高温 |
| B.聚氨酯属于加聚型高分子材料 |
| C.聚氨酯属于纯净物 |
| D.聚氨酯材料没有固定的熔点 |