某同学采用硫铁矿焙烧取硫后的烧渣(主要成分为Fe2O3、SiO2、Al2O3,不考虑其他杂质) 制取七水合硫酸亚铁(FeSO4·7H2O) ,设计了如下流程: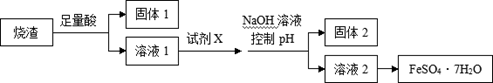
下列说法不正确的是
| A.溶解烧渣选用足量硫酸,试剂X选用铁粉 |
| B.固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al(OH)3,进入固体2 |
| C.从溶液2得到FeSO4·7H2O产品的过程中,须控制条件防止其氧化和分解 |
| D.若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4·7H2O |
现有KCl和KBr的混合物3.87 g,将混合物全部溶于水,并加入过量的AgNO3溶液,充分反应后产生6.63 g沉淀物,则原混合物中钾元素的质量分数为
| A.24.1% | B.25.9% | C.40.3% | D.48.1% |
将11.2g的Mg—Cu混合物完全溶解于足量的硝酸中,收集反应产生的x气体。再向所得溶液中加入适量的NaOH溶液,产生21.4g沉淀。根据题意推断气体x的成分可能是
| A.0.3mol NO2和0.3mol NO |
| B.0.2mol NO2和0.1mol N2O4 |
| C.0.1mol NO、0.2mol NO2和0.05mol N2O4 |
| D.0.6mol NO |
一定温度下,向饱和NaOH溶液中加入一定量的钠块,充分反应后恢复到原温度,下列说法正确的是
| A.溶液中溶质质量增加,溶剂质量减少,溶液中溶质的质量分数变大 |
| B.溶液的pH不变,有氢气放出 |
| C.溶液中的Na+数目减小,有氧气放出 |
| D.溶液中的c(Na+)增大,有氧气放出 |
在K2CO3样品中含Na2CO3、KNO3、Ba(NO3)2中的一或二种杂质.将13.8 g该样品溶于足量水中得到澄清溶液,再加入过量CaCl2溶液,可得9.0 g沉淀,则原样品中含有的杂质会是
| A.肯定有KNO3,没有Ba(NO3)2,可能还有Na2CO3 |
| B.肯定有Na2CO3,没有Ba(NO3)2 |
| C.肯定没有Na2CO3,Ba(NO3)2 |
| D.无法判断何种为肯定或否定的杂质 |
化学方程式可简明地体现元素及其化合物的性质。已知:
氧化还原反应:2FeCl3+2HI=2FeCl2+I2+2HCl; 2Co(OH)3+6HCl =2CoCl2+Cl2↑+6H2O;
2Fe(OH)2+ I2+2KOH = 2Fe(OH)3+2KI; 3I2+6KOH=5KI+KIO3+3H2O
复分解反应:2HSCN +K2CO3 =" 2KSCN" + CO2 ↑ + H2O; KCN + CO2 + H2O =" HCN" + KHCO3
热分解反应:4NaClO 3NaCl + NaClO4;NaClO4
3NaCl + NaClO4;NaClO4  NaCl + 2O2↑
NaCl + 2O2↑
下列说法不正确是
| A.酸性(水溶液):HSCN > H2CO3 > HCN |
| B.还原性(碱性溶液):Fe(OH)2 > I2 > KIO3 |
| C.热稳定性:NaCl > NaClO4 > NaClO |
| D.氧化性(酸性溶液):FeCl3 > Co(OH)3 > I2 |