从明矾[KAl(SO4)2·12H2O]制备Al、K2SO4和H2SO4的流程如下:
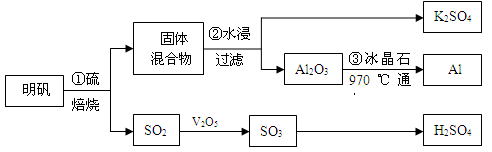
已知:明矾焙烧的化学方程式为:4[KAl(SO4)2·12H2O] + 3S=2K2SO4 + 2Al2O3 + 9SO2↑+ 48H2O
请回答下列问题:
(1)在焙烧明矾的反应中,氧化产物与还原产物的物质的量之比为: 。
(2)步骤②中,为提高浸出率,可采取的措施有_____________。
| A.粉碎固体混合物 | B.降低温度 | C.不断搅拌 | D.缩短浸泡时间 |
(3)明矾焙烧完全后,从步骤②的滤液中得到K2SO4晶体的方法是 。
(4)步骤③电解的化学方程式是 ,电解池的电极是用碳素材料做成,电解过程中,阳极材料需要定期更换,原因是: 。
(5)以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时NiO(OH)
转化为Ni(OH)2,则该电池的正极电极反应式是 。
(6)焙烧a吨明矾(摩尔质量为b g/mol),若SO2的转化率为96%,可生产质量分数为98%的H2SO4质量为 吨(列出计算表达式)。
(6分)已知碳有两种常见的同位素126C、136C;氧有三种常见的同位素168O、178O、188O。
(1)由这五种微粒构成的CO的分子有种。
(2)本题中涉及种核素,种元素。
(3)一个相对分子质量最大的二氧化碳分子中有个电子,个中子;0.5 mol这种二氧化碳的质量是g。
(6分)单晶硅是制作电子 集成电路的基础材料。科学家预计,到2011年一个电脑芯片上将会集成10亿个晶体
集成电路的基础材料。科学家预计,到2011年一个电脑芯片上将会集成10亿个晶体 管,其功能远比我们想象的要大的多,这对硅的纯度要求很高。用化学方法可制得高纯度硅,其化学方程式为:①SiO2 + 2C
管,其功能远比我们想象的要大的多,这对硅的纯度要求很高。用化学方法可制得高纯度硅,其化学方程式为:①SiO2 + 2C Si + 2CO②Si + 2Cl2
Si + 2CO②Si + 2Cl2 SiCl4
SiCl4
③SiCl4 + 2H2 Si + 4HCl。回答下列问题:
Si + 4HCl。回答下列问题:
(1)上述反应中,属于氧化还原反应的是(填序号)。
(2)反应①和③属于。
A.化合反应 B.分解反应 C.置换反应 D.复分解反应
(3)下列描述正确的是。
A.氧化还原反应都是置换反应
B.判断一个反应是否为氧化还原反应的依据是是否有化合价的升降
C.化合反应全部都是氧化还原反应 D.复分解反应全部都是氧化还原反应
(8分)(1)从30mL0.5mol·L-1 NaOH溶液中取出10 mL:这10 mL溶液的物质的量浓度是mol·L-1,其中的溶质质量是g。
(2)将30mL0.5mol·L-1 NaOH溶液加水稀释到500mL,稀释后溶液中NaOH的物质的量浓度是mol·L-1。
(3)现有体积相同的NaCl、MgCl2、AlCl3三种溶液,分别加入足量的硝酸银溶液,Cl-沉淀完全时,消耗等物质的量的AgNO3,则三种溶液的物质的量浓度之比为。
(4分)下列物质:①H2SO4②NaOH ③NaCl ④CO2 ⑤Cu ⑥蔗糖 ⑦H2CO3⑧盐酸属于电解质的是;属于非电解质的是。(填序号)
请利用下列装置及试剂组装一套装置。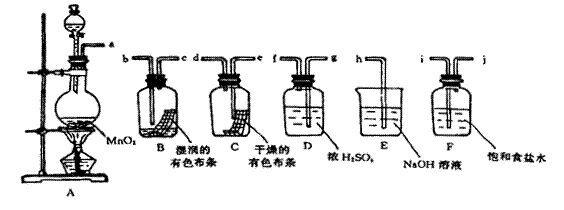
其流程是,先制取纯净干燥的Cl2(不收集),后试验干燥的Cl2和潮湿的Cl2有无漂白性。
(1)按气体从左向右流向将各装置依次连接起来(填字母序号):
a接____ _____ 接 ___________接_____________接______ _______ 接h 。
(2)烧 瓶
瓶 中发生反应的化学方程式是。
中发生反应的化学方程式是。
(3)E装置的作用是,F装置的作用是。
(4)C瓶中的现象是,B瓶中的现象是。以上事实说明起漂白作 用的物质是。
用的物质是。