发生在天津港“8•12”特大火灾爆炸事故,再一次引发了人们对环境问题的关注.
(1)为了减少空气中SO2的排放,常采取的措施是将煤转化为清洁气体燃料.
已知:H2(g)+ O2(g)═H2O(g)△H1=﹣241.8kJ•mol﹣1
O2(g)═H2O(g)△H1=﹣241.8kJ•mol﹣1
C(s)+ O2(g)═CO(g)△H2=﹣110.5kJ•mol﹣1
O2(g)═CO(g)△H2=﹣110.5kJ•mol﹣1
则焦炭与水蒸气反应生成CO的热化学方程式为: .
(2)由于CaC2、金属钠、金属钾等物质能够跟水反应给灾后救援工作带来了很多困难.如果在实验室,你处理金属钠着火的方法是 .
(3)事故发生后,爆炸中心区、爆炸区居民楼周边以及海河等处都受到了严重的氰化物污染.处理NaCN的方法是:用NaClO在碱性条件下跟NaCN反应生成无毒害的物质,试写出该反应的离子反应方程式 .
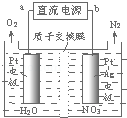
(4)电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO3-的原理如图所示,电源正极为 (填“a”或“b”);若总反应为4NO3﹣+4H+═5O2↑+2N2↑+2H2O,则阴极反应式为 .
(5)欲降低废水中重金属元素铬的毒性,可将Cr2O72﹣转化为Cr(OH)3沉淀除去,
已知在常温下:Ksp[Fe(OH)2]=1×10﹣15、Ksp[Fe(OH)3]=1×10﹣38、Ksp[Cr(OH)3]=1×10﹣23,当离子浓度在1×10﹣5mol/L以下时认为该离子已经完全沉淀,请回答:
①相同温度下Fe(OH)3的溶解度 Cr(OH)3的溶解度(填“>”、“<”或“=”)
②浓度为0.1mol/L的Fe2+与10.0mol/L Cr3+同时生成沉淀的pH范围是 .
以化合物A为原料合成化合物M的线路如下图所示:
已知: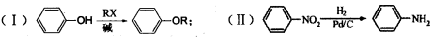
(1)写出下列反应的反应类型:反应①:;反应④:。
(2)写出化合物B中含氧官能团的名称:和。
(3)反应⑤中除生成M外,还有CH3OH生成。请写出物质A和Y的结构简式:
AY。
(4)写出同时满足下列条件的B的两种同分异构体的结构简式:和。
I.分子中含有苯环结构:
II.分子中有4种不同化学环境的氢:
Ⅲ.既能与FeCI3溶液发生显色反应,也能发生银镜反应
(5)反应②和反应③的次序不能颠倒,其原因是。
氨气是一种重要的化工原料,但随着工业化进程的加快,氨气也逐渐变成居室里一种重要的污染性气体。
(1)液氨和水类似,也能发生电离:NH3+NH3 NH4++NH2-,其离子积常数为l.0xl0-30。现将2.3g金属钠投入1.0 L液氨中,则液氨电离平衡____移动(填“不”、“正方向”、“逆方向”);待反应结束后,假设溶液的体积不变,所得溶液中NH4+的浓度为____。
NH4++NH2-,其离子积常数为l.0xl0-30。现将2.3g金属钠投入1.0 L液氨中,则液氨电离平衡____移动(填“不”、“正方向”、“逆方向”);待反应结束后,假设溶液的体积不变,所得溶液中NH4+的浓度为____。
(2)实验室模拟工业上用氮气和氢气合成氨气时,在反应前将两种气体通过图装置,该装置的作用有三个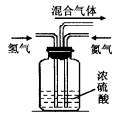
①将氮气和氢气干燥:
②使氮气和氢气充分混合;
③____,从而提高氮气和氢气的利用率。
(3)实验室可用氨气通过红热的氧化铜制取氮气,写出该反应的化学方程式:____。
(4)家庭空气中的氨主要来自建筑施工中使用的混凝土外加剂,如混凝土防冻剂尿素会和水缓慢发生反应:CO(NH2)2(s)+H2O(g) 2NH3(g) +CO2(g),该反应的平衡常数表达式为K=。
2NH3(g) +CO2(g),该反应的平衡常数表达式为K=。
(5)已知:N2(g)+O2(g)=2NO(g); △H=180Kj·mol-l
4NH3(g)+5O2(g) =4NO(g)+6H2O(g); △H= -908Kj·mol-l
请写出氨气被一氧化氮氧化生成氮气和气态水的热化学方程式:。
(10分)偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2(l)+2N2O4(l) 2CO2(g)+3N2(g)+4H2O(g) (Ⅰ)
2CO2(g)+3N2(g)+4H2O(g) (Ⅰ)
(1)反应(Ⅰ)中氧化剂是。
(2)火箭残骸中常现红棕色气体,原因为:N2O4(g) 2NO2(g) (Ⅱ)当温度升高时,气体颜色变深,则反应(Ⅱ)为(填“吸热”或“放热”)反应。
2NO2(g) (Ⅱ)当温度升高时,气体颜色变深,则反应(Ⅱ)为(填“吸热”或“放热”)反应。
(3)一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是。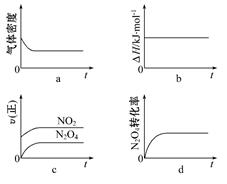
若在相同温度下,上述反应改在体积为1 L的恒容密闭容器中进行,平衡常数(填“增大”、“不变”或“减小”),反应3 s后NO2的物质的量为0.6 mol,则0 s~3 s内的平均反应速率v(N2O4)=mol·L-1·s-1。
按以下装置图进行实验,填写有关现象及化学方程式。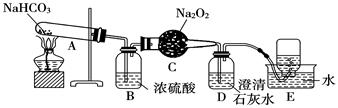
(1)A中现象是____________________,
(2)B中浓硫酸的作用是_______________,
(3)C中发生反应的化学方程式为______________,
(4)D中现象是_______________;反应的离子方程式是_______________________,
(5)E中收集的气体是____________。
KClO3和浓盐酸在一定温度下反应会生成黄绿色的易爆物二氧化氯。
(1)请完成该过程的化学方程式并配平。
____KClO3+____HCl(浓)===____KCl+____ClO2↑+____Cl2↑+____()
(2)浓盐酸在反应中显示出来的性质是________________(填写编号)。
①氧化性 ②还原性 ③酸性 ④碱性
(3)若反应生成0.1 mol Cl2,则转移的电子数为__________________________。
(4)ClO2具有很强的氧化性。因此,常被用作消毒剂,其消毒的效率(以单位质量得到的电子数表示)是Cl2的______倍。(提示:Cl2和ClO2在消毒过程中均变为Cl-)