电化学降解法可用于治理水中硝酸盐的污染。电化学降解NO的原理如图所示,下列说法不正确的是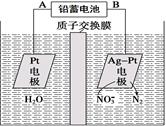
| A.铅蓄电池的A极为正极,电极材料为PbO2 |
B.该电解池的总反应方程式为:2H2O + 4NO3-  2N2↑+ 5O2↑+ 4OH- 2N2↑+ 5O2↑+ 4OH- |
| C.该电解池的阴极反应式为:2NO3- + 12H+ + 10e- = N2↑ + 6H2O |
| D.若电解过程中转移2mol电子,则交换膜右侧电解液的质量减少5.6g |
现在MgCl2、AlCl3、CuCl2、FeCl3四种溶液只用一种试剂把它们区别开,这种试剂是
| A.氨水 | B.AgNO3 | C.NaOH溶液 | D.NaCl |
下列氧化物投入稀盐酸中,能形成无色透明溶液的是
| A.MgO | B.CuO | C.Fe2O3 | D.FeO |
火星中存在一种含铁元素的矿物,化学式为KFe3(SO4)2(OH)6,其中Fe元素的化合价为
| A.+2 | B.+3 | C.0 | D.-2 |
可逆反应达到平衡的重要特征是( )
| A.反应停止了 | B.正、逆反应的速率相等 |
| C.正、逆反应都还在进行 | D.正、逆反应的速率均为零 |
按物质的分类方法,HNO3应属于
①酸②氢化物③氧化物④含氧酸⑤难挥发性酸⑥强氧化性酸⑦一元酸⑧化合物⑨混合物
| A.①②③④⑤⑥⑦⑧ | B.①④⑥⑦⑧ |
| C.①⑨ | D.①④⑤⑥⑦ |