在溶液中加入足量Na2O2后仍能大量共存的离子组是
| A.NH4+、Ba2+、Cl-、NO3- | B.K+、AlO2-、C1-、SO42- |
| C.Ca2+、Mg2+、NO3-、HCO3- | D.Na+、C1-、SO32-、SO42- |
关于胶体和溶液的区别,下列叙述中正确的
| A.溶液呈电中性,胶体带电荷 |
| B.溶液中通过一束光线出现明显光路,胶体中通过一束光线没有特殊现象 |
| C.溶液中溶质粒子能通过滤纸,胶体中分散质粒子不能通过滤纸 |
| D.溶液与胶体的本质区别在于分散质微粒直径大小,前者小于1nm,后者介于1nm和100nm之间 |
下列叙述中,正确的是
| A.含金属元素的离子不一定都是阳离子 |
| B.在氧化还原反应中,非金属单质一定是氧化剂 |
| C.某元素由化合态变为游离态时,该元素一定被还原 |
| D.金属阳离子被还原一定得到金属单质 |
下列离子在酸性溶液中能大量共存的是
A.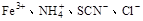 |
B.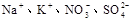 |
C.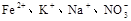 |
D.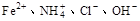 |
下列叙述错误的是
| A.物质的量是国际单位制中七个基本物理量之一 |
| B.0.016kg16O 含有约6.02×1023个氧原子 |
| C.单位物质的量的任何物质都含有约6.02×1023个原子 |
| D.一定温度、压强下,气体体积由其分子数目的多少决定 |
下列关于化学与生产、生活的认识不正确的是
| A.CO2、CH4、N2等均是造成温室效应的气体 |
| B.使用清洁能源是防止酸雨发生的重要措施之一 |
| C.节能减排符合低碳经济的要求 |
| D.合理开发利用可燃冰(固态甲烷水合物)有助于缓解能源紧缺 |